题目内容
14.用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )| A. | 2.7g A1与NaOH溶液完全反应,转移的电子数为0.2NA | |
| B. | 常温下,2.24L N2和O2的混合气体分子数为0.1NA | |
| C. | O.1 mol的14C中,含有的电子数为0.8NA | |
| D. | 0.1 mol H2(g)和0.3molCl2(g)于密闭容器中充分反应后,容器中气体分子总数为0.4NA |
分析 A.Al与NaOH溶液反应生成Na[Al(OH)4];
B.常温下,不能用气体摩尔体积22.4L/mol;
C.1mol14C中含有电子数为6mol;
D.H2(g)和Cl2(g)反应生成HCl(g).
解答 解:A.Al与NaOH溶液反应生成Na[Al(OH)4],Al从0价变为+3价,2.7gAl即0.1molAl参加反应,转移的电子数为0.3NA,故A错误;
B.常温下,不能用气体摩尔体积22.4L/mol,则2.24L N2和O2的混合气体分子数不为0.1NA,故B错误;
C.1mol14C中含有电子数为6mol,则0.1 mol的14C中,含有的电子数为0.6NA,个C错误;
D.H2(g)和Cl2(g)反应生成HCl(g),反应方程式为H2(g)+Cl2(g)═2HCl(g),0.1 mol H2(g)和0.3molCl2(g)于密闭容器中充分反应后,反应生成0.2molHCl(g),剩余0.2molCl2(g),则容器中气体分子总数为0.4NA,故D正确.
故选D.
点评 本题考查阿伏伽德罗常数的计算,明确一些常见的反应,注意气体摩尔体积22.4L/mol使用的条件是标准状况,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
10.少量铁片与过量的l00mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②改用50mL 1mol/L HNO3溶液 ③滴入几滴浓盐酸 ④加入少量铜粉 ⑤滴入几滴硫酸铜溶液 ⑥升高温度(不考虑盐酸挥发) ⑦改用50mL 0.1mol/L盐酸.
①加H2O ②改用50mL 1mol/L HNO3溶液 ③滴入几滴浓盐酸 ④加入少量铜粉 ⑤滴入几滴硫酸铜溶液 ⑥升高温度(不考虑盐酸挥发) ⑦改用50mL 0.1mol/L盐酸.
| A. | ②⑥⑦ | B. | ③④⑤ | C. | ③⑤⑥ | D. | ③④⑥⑦ |
5. 常温下,向20mL的某稀盐酸中滴入0.1mol•L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图.下列分析不正确的是( )
常温下,向20mL的某稀盐酸中滴入0.1mol•L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图.下列分析不正确的是( )
 常温下,向20mL的某稀盐酸中滴入0.1mol•L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图.下列分析不正确的是( )
常温下,向20mL的某稀盐酸中滴入0.1mol•L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图.下列分析不正确的是( )| A. | V2=20 mL | B. | d点溶液中:c(NH4+)>c(Cl-) | ||
| C. | b点溶液中:c(H+)=c(OH-) | D. | 该稀盐酸的浓度为0.1 mol•L-1 |
2.某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol•L-1.往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.某同学另取少量原溶液,设计并完成如下实验:则关于原溶液的判断中正确的是( ) 

| A. | 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定 | |
| D. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
6.下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C-H键:413kJ/mol、H-H键:436.0kJ/mol,乙炔的结构是为H-C≡C-H.则下列叙述正确的是( )
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/(kJ/mol) | 890.3 | 1299.6 | 285.8 |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| B. | CH4和C2H2中所含化学键完全相同 | |
| C. | 2CH4(g)═C2H2(g)+3H2(g)△H=-376.4kJ/mol | |
| D. | C≡C键能为796.0kJ/mol |
3.下列关于化学键及晶体的说法中,正确的是( )
| A. | 分子晶体中一定含有共价键,离子晶体中可能含有共价键 | |
| B. | 原子或离子之间强烈的相互吸引作用叫做化学键 | |
| C. | 金刚石、石墨、足球烯互为同素异形体,但晶体类型不同 | |
| D. | HCl溶于水能电离出氢离子和氯离子,故HCl是离子化合物 |
19.下列卤代烃在NaOH醇溶液中加热不发生消去反应的是( )
①
②
③(CH3)3CCH2Cl
④
⑤
⑥CH3Cl.
①

②

③(CH3)3CCH2Cl
④

⑤

⑥CH3Cl.
| A. | ①③⑥ | B. | ②③⑤ | C. | 全部 | D. | ②④ |
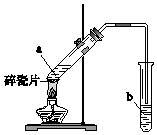 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯. 