��Ŀ����
��9�֣�ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��
| ʵ���� �Լ� | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
��1��������ͼװ�����Ƚϸ÷�Ӧ�ķ�Ӧ���ʿ���������Ӧ���Ũ�ȡ�����������Ӱ�����ʵ�����ȷ��֮����ͨ���� ��(��)�㷴Ӧ���ʡ�

��2��Ϊʵ��ʵ��Ŀ�ģ���V1= ��V2= ��
V3= ��V4= ��
��3�������������յ�֪ʶ�жϣ�������ʵ���з�Ӧ�������Ŀ����� ���ʵ���š���
��4����֪Fe3+��H2O2�ֽ�Ļ����ɷ�������Ӧ���У����е�һ����ӦΪ��2Fe3+ + H2O2 ==2Fe2+ + O2��+ 2H+����ڶ�����Ӧ�����ӷ���ʽΪ��
��
��1����ͬʱ�����ռ�����������������ռ���ͬ�������������Ҫ��ʱ�䣩��2�֣���
��2��20.0�� 20.0�� 10.0�� 5.0 ����1�֣� ��3��C ��1�֣�
��4��2Fe2+ + H2O2 + 2H+ ="=" 2Fe3+ + 2H2O��2�֣�
����

��ϰ��ϵ�д�
�����Ŀ
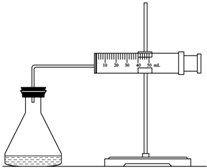 ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��
ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ�� 2SO3��Ӧ�У�SO2��ת���ʲ��ܴﵽ100%
2SO3��Ӧ�У�SO2��ת���ʲ��ܴﵽ100%