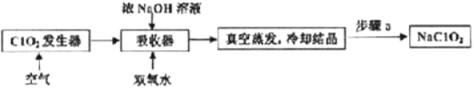
题目内容
【题目】有些汽车安装了安全气囊,气囊中装有叠氮化钠(![]() )等固体粉末。一旦汽车发生强烈的撞击,叠氮化钠将迅速分解生成钠和氮气(
)等固体粉末。一旦汽车发生强烈的撞击,叠氮化钠将迅速分解生成钠和氮气(![]() ),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
(1)写出叠氮化钠发生分解反应的化学方程式:____________________。
(2)写出安全气囊中选用叠氮化钠的理由:____________________。
【答案】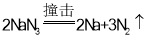 叠氮化钠分解生成的氮气化学性质稳定且对空气无污染
叠氮化钠分解生成的氮气化学性质稳定且对空气无污染
【解析】
(1)叠氮化钠发生分解反应生成钠和氮气;
(2)根据氮气的性质回答。
(1)叠氮化钠发生分解反应生成钠和氮气,反应的化学方程式是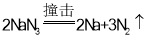 ;
;
(2)叠氮化钠分解生成的氮气化学性质稳定且对空气无污染,所以安全气囊中选用叠氮化钠。

【题目】二甲胺是农药螟铃畏的重要中间体,在一定温度压强及催化剂条件下由氨与甲醇作用而制得,反应原理为:2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g)
已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
②2NH3(g)+![]() O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
③CH3NHCH3(g)+![]() O2(g)=2CO2(g)+
O2(g)=2CO2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH=-1872.6 kJ·mol-1
N2(g) ΔH=-1872.6 kJ·mol-1
(1)写出CH3OH(g)与NH3(g)转化为CH3NHCH3(g)和H2O(g)的热化学方程式是____________。
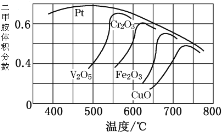
(2)不同的催化剂对二甲胺合成催化效率不同(如图所示),则最合适的催化剂及温度是_____________
(3)一定条件下,原料气中n(CH3OH)/n(NH3)比值和温度对NH3平衡转化率影响的实验数据如图:
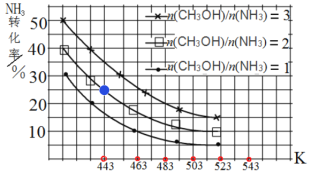
①温度为443 K时,在1 L反应容器中投入4 mol NH3和8 mol CH3OH进行反应,试计算达到平衡时CH3NHCH3(g)浓度为_________molL-1,该温度下化学平衡常数为_____________
②结合图中数据,归纳 NH3平衡转化率受外界条件影响的变化规律:a:_______b:________
(4)二甲胺水溶液类似于氨水,呈碱性;则二甲胺在水中的电离方程式为__________
(5)常温下,将二甲胺和盐酸等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号 | 二甲胺浓度(mol.L-1) | 盐酸浓度(mol.L-1) | 混合后溶液的PH |
甲 | 0.1 | 0.1 | a |
乙 | 0.15 | 0.1 | 8 |
丙 | 0.2 | 0.1 | 10 |
①实验甲中,a______(填“大于”、“小于”或“等于”)7
②实验丙混合后的溶液中离子浓度大小关系为______________
【题目】在2 L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度为__________ mol/L;升高温度,NO的浓度增大,则该反应是________(填“放热”或“吸热”)反应。
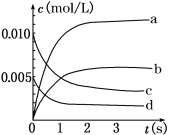
(2)如下图中表示NO2变化的曲线是________(填字母序号a、b、c、d)。用O2表示从0~2 s内该反应的平均速率v=________ mol/(L·s)。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂