题目内容
(1)回收二氯化锰.将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热,试写出MnO(OH)与浓盐酸反应的化学方程式:
| ||
| ||
(2)萃取法回收锰离子.实验室萃取操作中使用的玻璃仪器是
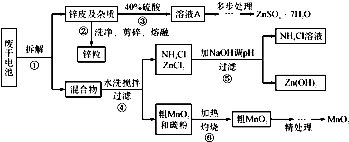
(3)制备锰锌铁氧体.锰锌铁氧体可用作隐形飞机吸收雷达波的涂料.一种以锌锰废电池为原料制备锰锌铁氧体的主要流程如图1:

①除汞时,铁粉的作用是
②据图说明pH对Hg吸收率的影响规律
③在强酸性环境下Hg的吸收率高的原因可能是
(4)锰回收新方法.向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为:
2MnO(OH)+MnO2+2H 2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O,
①每1molMnO2参加反应时,共有
②新方法的优点是
成,不造成二次污染;废物资源化等
成,不造成二次污染;废物资源化等
(2)根据萃取的操作分析;
(3)①利用铁粉把Hg还原出来;
②根据图象分析;
③根据影响KMnO4氧化性的条件分析;
(4)①根据氧化还原反应方程中得失电子守恒分析;
②分析回收工艺的优点从可操作性、产品的纯度、对环境的影响等方面分析.
| ||
| ||
(2)根据萃取的操作可知,萃取操作中使用的玻璃仪器是分液漏斗,故答案为:分液漏斗;
(3)①铁粉具有还原性,能把汞离子还原为汞单质,所以铁粉的作用是还原剂,故答案为:还原剂;
②由图象可知,汞的吸收率随着PH的增大先降低后增加,故答案为:随pH的升高汞的吸收率先降低后增加;
③在中性或碱性条件下KMnO4氧化性较低,而酸性条件下氧化性较强,所以作氧化剂时一般用酸性高锰酸钾溶液,故答案为:KMnO4在酸性条件下氧化性强;
(4)①已知2MnO(OH)+MnO2+2H 2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O,MnO2~2H 2C2O4~4CO2,碳元素从+3价升高到+4,转移1个电子,当生成4molCO2时转移4mol电子,所以1molMnO2参加反应时生成4molCO2,转移4mol电子,故答案为:4;
②分析回收工艺的优点从可操作性、产品的纯度、对环境的影响等方面分析,可知工艺流程简单;生成CO2和H2O不影响MnSO4纯度;反应过程无有毒有害物质生
成,不造成二次污染;废物资源化等,
故答案为:工艺流程简单;生成CO2和H2O不影响MnSO4纯度;反应过程无有毒有害物质生成,不造成二次污染;废物资源化等.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案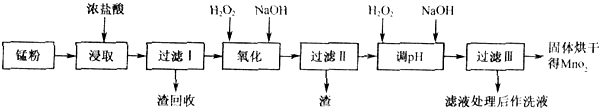
根据如图所示步骤并参考表格数据,回答下列问题.
生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
(3)过滤Ⅰ所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为
(5)实验室进行过滤操作时.需要用到的玻璃仪器有

根据上图所示步骤并参考表格数据,回答下列问题.
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
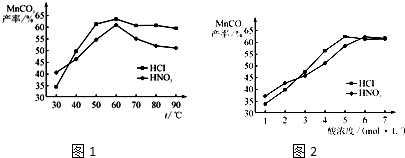
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:

(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
|
NH3·H2O的Kb |
Zn2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
|
1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为 (填序号)。
a.9 b.10 c.11
(4) MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为 ;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是 ;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为 。
(5) 查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
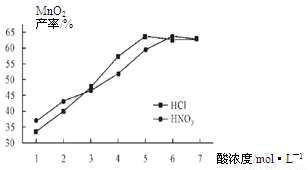
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图4,由图看出两种酸的最佳浸泡温度都在 ℃左右;
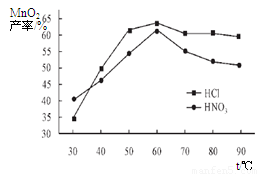
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图5,由图看出硝酸的最佳浓度应选择 mol/L左右。