题目内容
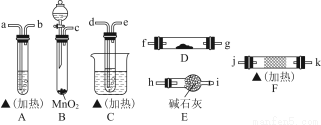
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用图所示装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。
装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B. 3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
A
【解析】A装置的质量差确定产生的O2、SO2、SO3质量共计为5 g,B装置的质量差确定SO2、SO3的质量和为4.5 g,即O2的质量为0.5 g,根据电子守恒有:n(SO2)∶n(O2)=2∶1,质量比为m(SO2)∶m(O2)=4∶1,据此确定SO2的质量为2 g、SO3的质量为2.5 g,因此O2、SO2、SO3物质的量之比为1∶2∶2,A项正确。

练习册系列答案
相关题目