题目内容
【题目】NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
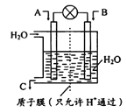
(1)如图所示,利用电化学原理将NO2 转化为重要化工原料C。
若A为NO2,B为O2,则负极的电极反应式为___________;
(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、
聚酯类材料的生产,工业上通过
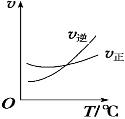
Cl2(g)+CO(g) ![]() COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
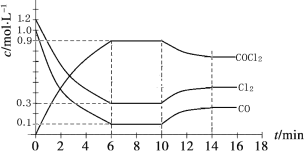
0~6 min内,反应的平均速率v(Cl2)= ;
保持温度不变,在第7min 向体系中加入这三种物质各2mol,则平衡向____________ 方向移动(填“正反应”、“逆反应”或“不”);
将初始投料浓度变为c(Cl2)=0.7mol/L、c(CO)=0.5mol/L、c(COCl2)=______ mol/L,
保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
温度升高,该反应平衡常数变化的趋势是______;(填“增大”、“减小”或“不变”)
比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8)_____T(15)
(填“<”、“>”或“=”)
【答案】30.(1)NO2-e-+H2O=NO3-+2H+
(2) ①0.15 molL-1min -1 ②平衡正向移动 ③ 0.5 ④ 减小 ⑤<
【解析】
试题分析:(1)该装置图是原电池,利用原电池原理将NO2 转化为重要化工原料C,因为A为NO2,B为O2,电解质为酸溶液,则C为硝酸,在负极,NO2失电子生成硝酸,所以负极的电极反应式为NO2-e-+H2O= NO3-+2H+。
(2)①根据图像可知,在0-6 min内,氯气的浓度减小了1.2mol/L-0.3mol/L=0.9mol/L,则反应的平均速率v(Cl2)=0.9mol/L÷6min=0.15 molL-1min -1.
②根据图像提供的数据,化学平衡常数为K=0.9÷(0.3×0.1)=30,假设容器体积为1L,保持温度不变,在第7min 向体系中加入这三种物质各2mol,Q=2.9÷(2.3×2.1)<30,平衡向正反应方向移动。
③最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同,说明这两种状态属于等效平衡状态,若初始投料浓度变为c(Cl2)=0.7mol/L、c(CO)=0.5mol/L、根据等效平衡理论,c(COCl2)=1.2-0.7=0.5mol/L,
④根据图像可知,温度升高,平衡向逆反应方向移动,则化学平衡常数减小。
⑤第8min时反应处于平衡状态,在第10min时,CO和氯气的浓度增大,COCl2的浓度减小,说明平衡向逆反应方向移动,根据上述分析,温度升高,平衡向逆反应方向移动,所以T(8)< T(15)。

 口算能手系列答案
口算能手系列答案