题目内容
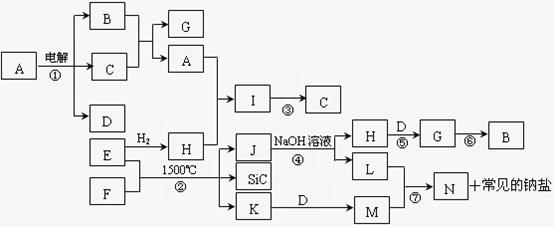
(11分)盐A(含结晶水)可发生如下的转化关系(部分生成物略去)。其中B、D、E为无色气体,C为白色沉淀,H为红褐色沉淀。在混合液X中加入BaCl2可生成不溶于稀HNO3的白色沉淀。

(1)写出由B→I的工业意义_______________________
(2)写出下列反应的化学方程式
G→I
C→H
(3)电解混合液X的阳极电极反应式为
(4)若盐A 1.960g和过量浓NaOH溶液加热充分反应,收集到B 224ml(标准状况),将H洗涤、烘干、灼烧、称量得0.400g,向混合液中加入盐酸酸化,再加入足量的BaCl2溶液,将沉淀过滤、洗涤、烘干、称量得2.33g,则A的化学式为___________________。

(1)写出由B→I的工业意义_______________________
(2)写出下列反应的化学方程式
G→I
C→H
(3)电解混合液X的阳极电极反应式为
(4)若盐A 1.960g和过量浓NaOH溶液加热充分反应,收集到B 224ml(标准状况),将H洗涤、烘干、灼烧、称量得0.400g,向混合液中加入盐酸酸化,再加入足量的BaCl2溶液,将沉淀过滤、洗涤、烘干、称量得2.33g,则A的化学式为___________________。
(1)工业制取硝酸 (2分)
(2)3NO2 +H2O="===" NO+2HNO3 (2分) 4Fe(OH)2+ O2 + 2H2O =" 4" Fe(OH)3 (2分)
(3)4OH- - 4e- = O2↑+ 2H2O (2分) (4)(NH4)2Fe(SO4)2 ? 6H2O (3分)
(2)3NO2 +H2O="===" NO+2HNO3 (2分) 4Fe(OH)2+ O2 + 2H2O =" 4" Fe(OH)3 (2分)
(3)4OH- - 4e- = O2↑+ 2H2O (2分) (4)(NH4)2Fe(SO4)2 ? 6H2O (3分)
试题分析:H为红褐色沉淀则为氢氧化铁,可推出C为氢氧化亚铁D为氧气, 混合液X中加入BaCl2可生成不溶于稀HNO3的白色沉淀。可推出中X含有硫酸根离子,再根据B→I的反应排除硫循环,只剩下熟悉的氮循环,则可推出B为氨气F为一氧化氮G为二氧化氮I为硝酸。
(1)根据B→I的反应可知其为工业制取硝酸。
(2)二氧化氮溶于水生成了一氧化氮和硝酸,氢氧化亚铁被空气氧化成氢氧化铁。
(3)X含有硫酸根离子和氢氧根离子,阴离子在阳极失去电子,根据电离顺序可知氢氧根离子失去电子。
(4)根据质量守恒原理和元素守恒原理,可计算出铵根离子、硫酸根离子、铁离子的质量,再根据质量守恒原理可计算出结晶水的质量,进而可推出相应的化学式。
点评:本题考查常见的铁、氮化合物之间的转化及其性质,以H为红褐色沉淀为突破点,学生需要掌握常见化合物的颜色以及其他特殊性质。

练习册系列答案
相关题目
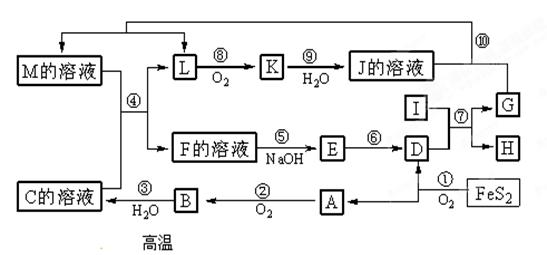 (提示:4FeS2+11O2
(提示:4FeS2+11O2 2Fe2O3+8SO2)
2Fe2O3+8SO2)