题目内容
【题目】在呼吸面具和潜水艇中可用过氧化钠作供氧剂,某课外活动小组设计了如下实脸装置,以证明过氧化钠可作供氧剂。装置A、B、C中盛装的试剂,可供选择的为:饱和NaHCO3溶液、CaCO3固体,NaOH 溶液,39gNa2O2固体。据下述装置回答问题:
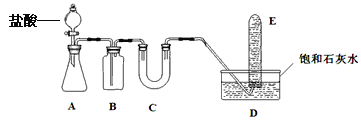
(1)盛盐酸的仪器名称_________________。
(2)B瓶中装__________,作用是_________________,反应的离子方程式_________________。
(3)若D中的石灰水出现出现轻微白色浑浊,请说明原因:_______________________。
(4)反应完毕时,若测得E中收集到的气体为520 mL,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值_________(填“大”或“小”),相差约_______mL,这是由于___________。
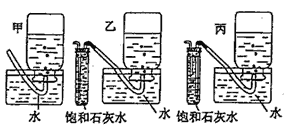
(5)为了使装置D部分更安全、合理,可将装置D改为下列________装置(用甲、乙、丙回答)
【答案】(1)分液漏斗(2)饱和NaHCO3溶液;吸收CO2中混有的HCl;
HCO3-+H+=H2O+CO2↑(3)C中有部分CO2未参加反应,流入D中生成沉淀
(4)小;40;Na2O2与CO2反应不完全(或其他合理答案)(5)乙
【解析】
试题分析:由实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,用排饱和石灰水法收集O2,注意收集氧气时,应防止倒吸。
(1)根据仪器构造可知盛盐酸的仪器名称分液漏斗;
(2)B为饱和碳酸氢钠溶液,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,方程式为HCO3-+H+ =H2O+CO2↑;
(3)二氧化碳能使澄清的石灰水变浑浊,若D中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应所致;
(4)39g过氧化钠即0.5mol过氧化钠完全反应生成氧气的体积为V
2Na2O2~~~~O2
2mol 22.4L
0.5mol 5.6L
V=560>520mL,所以实际收集到的氧气体积比理论计算值小,560mL-520mL=40mL;这是由于过氧化钠可能含有其它杂质与CO2反应不完全或D装置可能有氧气未被排出;
(5)D装置容易产生倒吸现象,所以不安全、不合理,所以需要改进;饱和石灰水能和二氧化碳反应,所以饱和石灰水的作用是吸收二氧化碳,收集较纯净的氧气,乙试管中进气管较长,二氧化碳能充分和饱和石灰水反应,丙试管中进气管较短,导致二氧化碳和饱和石灰水反应不充分,且随着气体的进入,试管中的液体被排到水槽中,答案选乙。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案