题目内容
【题目】已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F 与E位于同一周期,且是该周期元素中电负性最大的元素。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为____________(用化学式表示),原因是_____________________。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是____________。
(3)1 mol B2A2分子中含σ键的数目是____________。
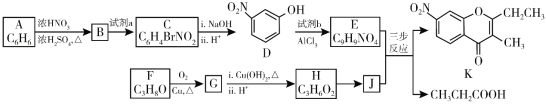
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有_____个原子,该晶体类型为________。


(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以_________相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
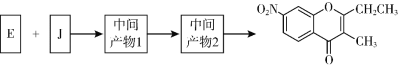
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于_______(填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__________。
【答案】SiO2>SiCl4 二氧化硅为原子晶体,而SiCl4为分子晶体 NH3分子间形成氢键,同族其他元素氢化物分子间不能形成氢键 3NA(或1.806×1024) 8 原子晶体 共价键 3 原子 sp3杂化
【解析】
已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小,则A为氢元素;B原子核外电子有6种不同的运动状态,核外电子数为6,则B为碳元素;D原子L层上有2对成对电子,则D外围电子排布为2s22p4,则D为氧元素。C的原子序数介于碳元素与氧元素之间,则C为氮元素;E元素在地壳中含量居第二位,则E为硅元素;F 与E位于同一周期,且是该周期元素中电负性最大的元素,F为氯元素。
由分析可知:A为氢元素、B为碳元素、C为氮元素、D为氧元素、E为硅元素、F为氯元素。
(1)E元素可分别与D元素、F元素形成两种常见化合物SiO2和SiCl4 ,这两种化合物的熔沸点高低顺序为SiO2>SiCl4 ,原因是二氧化硅为原子晶体,而SiCl4为分子晶体;
(2)C的氢化物NH3比下周期同族元素的氢化物PH3沸点还要高,其原因是NH3分子间形成氢键,同族其他元素氢化物分子间不能形成氢键。
(3)C2H2分子中含有1个C≡C叁键、2个C-H单键,叁键中含有1个σ键、2个π键,单键都是σ键,故1mol C2H2分子中含σ键的数目是3NA(或1.806×1024) ;
(4)由图(Ⅰ)中B元素的单质的晶胞结构示意图可知,该晶胞中4个C原子位于晶胞内部、6个C原子位于面心、8个C原子位于顶点上,故该晶胞中含有C原子数目=4+6×1/2+8×1/8=8;碳原子之间是以共价键结合形成空间网状结构,故该晶体类型为原子晶体。
(5)硅晶体和金刚石晶体都属于原子晶体,硅原子之间以共价键结合.在金刚石晶体的晶胞中,每个面心有一个碳原子,晶体硅有着类似结构,则面心位置贡献的原子为 6×1/2=3个;
(6)由CO2在高温高压下所形成的晶体的晶胞结构示意图可知.该晶体中相邻的原子间通过共价键形成空间网状结构晶体,故基属于原子晶体;该晶体中每个C原子形成4个C-O单键,故C原子轨道的杂化类型为sp3。