��Ŀ����
����Ŀ��������ԭ��Ӧ��һ����Ҫ�ķ�Ӧ���밴Ҫ�����������Ŀ��
��1���Է�ӦNH3+O2����NO+H2O(δ��ƽ)�����������õ����ŷ��������ת�Ƶķ������Ŀ�� ���÷�Ӧ�У��ǻ�ԭ�����ǻ�ԭ�������ԭ����������
��2����һ�������£���Ӧ2NH3+3CuO ![]() 3Cu+N2+3H2O��˳�����У��Դ˷�Ӧ�ķ�������������
3Cu+N2+3H2O��˳�����У��Դ˷�Ӧ�ķ�������������
�ٸ÷�Ӧ���û���Ӧ
�ڷ�Ӧ��NH3������ΪN2
���ڷ�Ӧ�������˽���ͭ�Ļ�ԭ��
���ڷ�Ӧ��ÿ����1 mol H2Oת��1 mol����
��3���ڷ�Ӧ2H2S+SO2=3S+2H2O�б�������Ԫ���뱻��ԭ��Ԫ�ص�������Ϊ ��
���𰸡�
��1��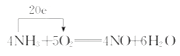 ,NH3,NO��H2O,O2
,NH3,NO��H2O,O2
��2����
��3��2��1
��������(1)�ɻ��ϼ۱仯��֪��NH3�ǻ�ԭ����O2����������NO���������������ǻ�ԭ���H2O�ǻ�ԭ���
(2)��Ӧ����û�е��ʲ��룬��һ�������û���Ӧ���ٴ�����Ӧ��NԪ�ػ��ϼ���3���ߵ�0����NH3������ΪN2������ȷ��NH3�ڷ�Ӧ�����ֻ�ԭ�ԣ��۴����ɻ��ϼ۱仯��֪���÷�Ӧת��6e����ÿ����1 mol H2Oת��2 mol���ӣ��ܴ���
(3)�ڷ�Ӧ��H2S��SԪ�ر�������SO2��SԪ�ر���ԭ������������֮��Ϊ2��1��

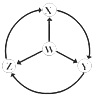
����Ŀ����ͼW��X��Y��ZΪ�������ʣ�����ͷ��ʾ��һ��ת���ij�����Ӧ�����г�������ʵ��ͼʾת����ϵ���ǣ� ��
ѡ�� | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Fe | FeCl3 | Fe��OH��2 | FeCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2��SO4��3 |
A.A
B.B
C.C
D.D