题目内容
14.为探究带有结晶水的复盐晶体X(共含五种元素)的组成和性质,设计并完成如下实验:
已知:气体F可使湿润的红色石蕊试纸变蓝色.请回答:
X含有的元素有S、O、H、Cu、N(用元素符号表示),则X的化学式为Cu3(NH4)4(SO4)5•5H2O.请写出C→E化学方程式CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O.
分析 为探究带有结晶水的复盐晶体X(共含五种元素)的组成和性质,X和足量氢氧化钠固体反应生成气体A中含氨气,通过碱石灰干燥得到气体F为氨气,物质的量=$\frac{8.96L}{22.4L/mol}$=0.4mol,说明X中含0.4mol铵根,反应后的固体加水溶解得到无色溶液B和黑色固体C,无色溶液B中加入足量氯化钡和稀盐酸生成白色沉淀D为BaSO4,其物质的量=$\frac{116.5g}{233g/mol}$=0.5mol,黑色固体C和乙醇蒸气反应生成红色固体E为铜,物质的量=$\frac{19.2g}{64g/mol}$=0.3mol,则X中含铵根、硫酸根、铜离子,据此分析判断.
解答 解:为探究带有结晶水的复盐晶体X(共含五种元素)的组成和性质,X和足量氢氧化钠固体反应生成气体A中含氨气,通过碱石灰干燥得到气体F为氨气,物质的量=$\frac{8.96L}{22.4L/mol}$=0.4mol,说明X中含0.4mol铵根,反应后的固体加水溶解得到无色溶液B和黑色固体C,无色溶液B中加入足量氯化钡和稀盐酸生成白色沉淀D为BaSO4,其物质的量=$\frac{116.5g}{233g/mol}$=0.5mol,黑色固体C和乙醇蒸气反应生成红色固体E为铜,物质的量=$\frac{19.2g}{64g/mol}$=0.3mol,则X中含铵根、硫酸根、铜离子,X含有的元素有S、O、H、Cu、N,结合足量计算所含结晶水,
83.4g晶体中含结晶水质量=83.4g-0.3mol×64g/mol-0.4mol×18g/mol-0.5mol×96g/mol=9g,水物质的量=$\frac{9g}{18g/mol}$=0.5mol,X的化学式结合微粒物质的量之比得到n(Cu):n(NH4+):n(SO42-):n(H2O)=0.3mol:0.4mol:0.5mol:0.5mol=3:4:5:5,化学式为Cu3(NH4)4(SO4)5•5H2O,C→E化学方程式为:CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O,
故答案为:Cu;N;Cu3(NH4)4(SO4)5•5H2O;CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O.
点评 本题考查了物质组成和的实验探究、元素守恒和反应现象是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 质子数为 16 | B. | 最外层电子数为 8 | ||
| C. | 与16N 互为同位素 | D. | 属于第二周期第 VIA 族元素 |

| A. | 使紫色石蕊试液变红 | B. | 易溶于水 | ||
| C. | 发生酯化反应 | D. | 无色无味 |
 四氧化三锰(Mn3O4)在电子工业有广泛应用.
四氧化三锰(Mn3O4)在电子工业有广泛应用.(1)金属锰与氧气在一定条件下反应可以制得Mn3O4,反应原理如图所示.
石墨为正极,该电极反应式为O2+2H2O+4e-=4OH-(或O2+2H2O+4NH4++4e-=4NH3•H2O).
(2)Mn3O4的一种工业制法:在常温下,往硫酸锰溶液中加入氨水,
控制溶液的pH 为10,使Mn2+转化为Mn(OH)2 沉淀,过滤,在NH4Cl 溶液
催化下通入氧气将滤渣氧化为Mn3O4.
①滤液中Mn2+的浓度为1.9×10-5mol/L(Ksp[Mn(OH)2]=1.9×10-13).
②滤渣转化为Mn3O4的化学方程式为6Mn(OH)2+O2$\frac{\underline{\;NH_{4}Cl\;}}{\;}$2Mn3O4+6H2O.
(3)加热MnCO3会同时发生如下三个反应:
| 序号 | 反应 | △H(kJ•mol-1) | K | |
| 300°C | 800°C | |||
| Ⅰ | MnCO3(s)+$\frac{1}{2}$O2(g)?MnO2(s)+CO2(g) | a | 3.0×107 | 1.8×105 |
| Ⅱ | MnCO3(s)+$\frac{1}{4}$O2(g)?$\frac{1}{2}$Mn2O3(s)+CO2(g) | b | 1.7×103 | 2.4×105 |
| Ⅲ | MnCO3(s)+$\frac{1}{6}$O2(g)?$\frac{1}{3}$Mn3O4(s)+CO2(g) | c | 9.8 | 9.6×104 |
②已知2CO(g)+O2(g)=2CO2(g)△H=d kJ•mol-1,则3MnO2+2CO(g)?Mn3O4(s)+2CO2(g) 的△H=(3c+b-3a)kJ/mol.
③在300℃条件下加热MnCO3 制取Mn3O4 并不合适,理由是:该温度下生成Mn3O4的反应平衡常数小,Mn3O4不是主要产物.800℃时,Mn2O3(s)+$\frac{1}{2}$O2(g)?MnO2(s) 的平衡常数K=$\frac{9}{16}$.
| A. | 乙烯和溴乙烷 | B. | 溴苯和环己烷 | C. | 苯和乙醛 | D. | 丙烯和乙醇 |
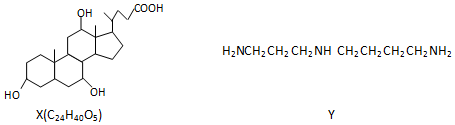
下列叙述错误的是( )
| A. | 1molX在浓硫酸作用下发生消去反应,最多生成3molH2O | |
| B. | 1molY发生类似酯化的反应,最多消耗2molX | |
| C. | X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 | |
| D. | Y与癸烷的分子链均呈锯齿形,但Y的极性较强 |


