题目内容
15.2008年8月奥运会在北京举行,下列有关说法中不正确的是( )| A. | 吉祥物福娃的材质之一是PVC(聚氯乙烯),其单体的结构简式为CH2=CHCl | |
| B. | “祥云”火炬的燃料为丙烷,分子中三个碳原子共面 | |
| C. | 奥运会上使用了锂电池为奥运村、媒体等处服务,这种高能电池的显著特点是提供相同的电量所需的金属正极质量最小 | |
| D. | 奥运“金镶玉”奖牌中的玉的化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2,它可用氧化物表示为2CaO•5MgO•8SiO2•H2O |
分析 A.聚氯乙烯的单体为氯乙烯;
B.三点确定一个平面;
C.锂电池中锂作负极;
D.根据硅酸盐改写成氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•SiO2•H2O,同时要遵循原子守恒.
解答 解:A.聚氯乙烯的单体为氯乙烯,氯乙烯的结构简式为CH2═CHCl,故A正确;
B.三点确定一个平面,分子中三个碳原子共面,故B正确;
C.锂电池中锂作负极,所需的金属负极质量最小,故C错误;
D.硅酸盐改写成氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•SiO2•H2O,同时要遵循原子守恒,故写成:2CaO•5MgO•8SiO2•H2O,故D正确.
故选C.
点评 本题考查聚合物、有机物的结构、原电池、硅酸盐改写成氧化物等知识,难度不大,注意基础知识的掌握.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
8.意大利科学家最近合成了一种新型的氧分子,其化学式为O4,下列关于O4的说法正确的是( )
| A. | 一个分子O4由两个分子O2构成 | |
| B. | O4是一种单质 | |
| C. | 等体积的O4和O2含有相同数目的分子 | |
| D. | 等质量的O4和O2含有相同数目的氧原子 |
6.锂被誉为“金属味精”以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源.工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂.其中一种工艺流程如下:
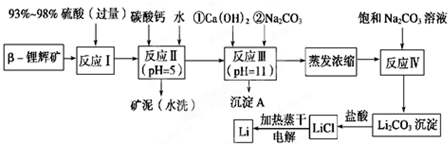
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如下表:
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2.
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH,使Fe3+、Al3+完全沉淀.
(3)写出沉淀A的成分Mg(OH)2、CaCO3.
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称过滤,洗涤所得Li2CO3沉淀要使用热水 (选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2.
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH,使Fe3+、Al3+完全沉淀.
(3)写出沉淀A的成分Mg(OH)2、CaCO3.
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称过滤,洗涤所得Li2CO3沉淀要使用热水 (选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
3.关于如图所示装置的叙述,错误的是( )


| A. | 锌是负极,其质量逐渐减小 | B. | 氢离子在铜表面被还原,产生气泡 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 电子从锌片经硫酸溶液流向铜片 |
10.分子式分别为C2H6O和C3H8O的醇在浓H2SO4和适当条件下发生脱水反应其产物可能有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
20.化合物X是一种重要的有机合成中间体,用于制造塑料、涂料和粘合剂等高聚物.为研究X的组成与结构,某研究小组进行了如下实验:
(4)化合物X与乙烯的共聚物是一种热熔型粘合剂.合成这种粘合剂的化学方程式是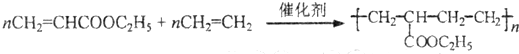 .
.
(5)研究小组以乙烯为原料,在实验室合成了化合物X.请写出合成路线流程图,并注明反应条件.
已知: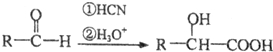
合成路线流程图示例如下:$→_{条件1}^{试剂1}$产物$→_{条件2}^{试剂2}$产物2…,下列合成步骤可以用完,也可以不用完,不够时也可以自己加.前面合成出来的物质可以作为原料在后面的合成中直接使用(如图).
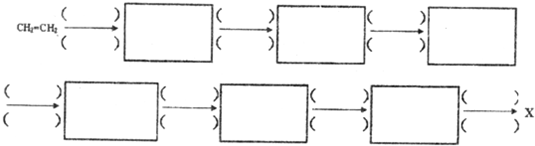
(6)工业上合成化合物X的一种方法可用如图表示:

已知: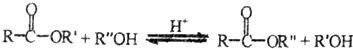
①1mol链状化合物A能与2mol H2发生反应,但A分子中不含有碳碳三键,则A的结构简式是CH2=C=O.
②B分子中含有四元环状结构,则反应I的反应类型是加成反应;反应Ⅱ的化学方程式是 .
.
③与(5)实验室制法比较,本方法的优点是步骤少,原子利用率高.
(1)化合物X的质谱图为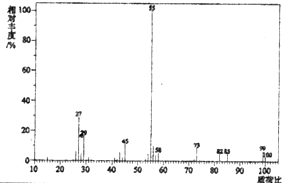 | (1)有机物X的相对分子质量是100. |
| (2)将10.0g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2g,KOH浓溶液增重22.0g. | (2)有机物X的分子式是C5H8O2. |
| (3)经红外光谱测定,化合物X中含有酯基,并有和羰基直接相连的碳碳双键;化合物 X的核磁共振氢谱图上有4个吸收峰,峰面积之比是2:1:2:3. | (3)X的结构简式是 . . |
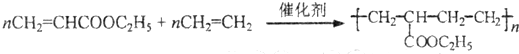 .
.(5)研究小组以乙烯为原料,在实验室合成了化合物X.请写出合成路线流程图,并注明反应条件.
已知:
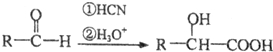
合成路线流程图示例如下:$→_{条件1}^{试剂1}$产物$→_{条件2}^{试剂2}$产物2…,下列合成步骤可以用完,也可以不用完,不够时也可以自己加.前面合成出来的物质可以作为原料在后面的合成中直接使用(如图).

(6)工业上合成化合物X的一种方法可用如图表示:

已知:
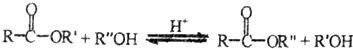
①1mol链状化合物A能与2mol H2发生反应,但A分子中不含有碳碳三键,则A的结构简式是CH2=C=O.
②B分子中含有四元环状结构,则反应I的反应类型是加成反应;反应Ⅱ的化学方程式是
 .
.③与(5)实验室制法比较,本方法的优点是步骤少,原子利用率高.
7.已知葡萄糖的燃烧热△H=-2804kJ/mol,当它氧化生成1g水时放出的热量是( )
| A. | 26.0kJ | B. | 155.8kJ | C. | 51.9kJ | D. | 467.3kJ |
5.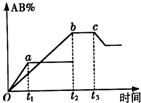 密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
 密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )| A. | A2、B2、AB均为气体,正反应放热 | |
| B. | AB为气体,A2、B2中最少有一种为非气体,正反应吸热 | |
| C. | AB为气体,A2、B2中最少有一种为非气体,正反应放热 | |
| D. | AB为固体,A2、B2中最少有一种为非气体,正反应吸热 |