��Ŀ����
����Ŀ����ʢ�ٴ�ѧ���о��ŶӲ������͵�̫�����ȹ�������ˮ�࣬��ʵ��C02���ŷš���������800�� ʱ��̼����ȷֽ��ΪCaO��CO2�������Ϊ���ڵ�̼���ƣ�����ԭ����ͼ��ʾ������˵������ȷ������ ��
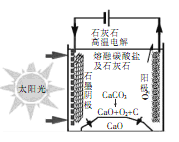
A����������������ת����ʽ�ǹ��ܡ�����ת��Ϊ��ѧ��
B��ʯī�缫�ĵ缫��ӦʽΪ3CO2 +4e- =C+ 2CO32-
C��������������̼���Ƶ����ʵ����������仯
D����������������11��2 LO2����ת��2 mol����
���𰸡�D
��������
���������A�����ݻ���ԭ��������������������ת���ǹ���ת���ɻ�ѧ�ܣ�����ת���ɻ�ѧ�ܣ���˵����ȷ��B��װ��ʾ��ͼ��������Ӧʽ3CO2��4e��=C��2CO32������˵����ȷ��C��������ӦʽΪ2CO32����4e��=2CO2����O2����ͨ������������Ӧʽ���Ƴ�̼���Ƶ����ʵ������䣬��˵����ȷ��D��û��ָ���Ƿ��DZ�״������˵������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����I | ��̼���ڸ��������»�ԭCuO |
����II | ������N2H4����ԭ����Cu��OH��2 |
����III | ��ⷨ����ӦΪ2Cu+H2O |
��1����֪��2Cu��s��+![]() O2��g��=Cu2O��s����H=��akJmol��1
O2��g��=Cu2O��s����H=��akJmol��1
C��s��+![]() O2��g��=CO��g����H=��bkJmol��1
O2��g��=CO��g����H=��bkJmol��1
Cu��s��+![]() O2��g��=CuO��s����H=��ckJmol��1
O2��g��=CuO��s����H=��ckJmol��1
��I�����ķ�Ӧ��2Cu O��s��+C��s��=Cu2O��s��+CO��g������H= kJmol��1��
��2����ҵ�Ϻ����÷���I��ȡCu2O�������ڷ���I��Ӧ���������ƣ������²������ή��Cu2O���ʣ������ԭ�� ��
��3������IIΪ������������Һ̬����N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ�ų�N2��
���Ʒ��Ļ�ѧ����ʽΪ ��
��4������III�������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ��д���缫��Ӧʽ
��˵����װ���Ʊ�Cu2O��ԭ�� ��
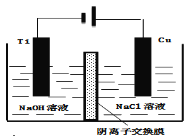
��5������ͬ���ܱ������У����������ַ����Ƶõ�Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺
2H2O��g��![]() 2H2��g��+O2��g����H��0��ˮ������Ũ����mol/L����ʱ��t��min��
2H2��g��+O2��g����H��0��ˮ������Ũ����mol/L����ʱ��t��min��
�仯���±���ʾ��
��� | Cu2O a�� | �¶� | 0 | 10 | 20 | 30 | 40 | 50 |
�� | ����II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
�� | ����III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
�� | ����III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
����������ȷ���� ������ĸ��������
a��ʵ����¶ȣ�T2��T1
b��ʵ����ǰ20min��ƽ����Ӧ����v��O2��=7��10��5molL��1min��1
c��ʵ������ʵ�������õ�Cu2O��Ч�ʸ�
d�� ʵ�������������Ļ�ѧƽ�ⳣ���Ĺ�ϵ��K1=K2��K3��


