题目内容
(1)Na2CO3溶液显______(填“酸性”、“中性”或“碱性”),原因是(用离子方程式表示)______.
(2)将0.1mol Na2CO3和0.1mol NaHCO3混合后完全溶于水,所得溶液离子浓度由大到小的顺序为______.
(3)在2支试管里分别加入少量Na2CO3和NaHCO3(各约1g),观察二者外观上的细小差别.分别滴入几滴水,振荡试管,用手触摸试管底部,感觉______.为进一步研究NaHCO3、Na2CO3和同浓度稀盐酸反应过程中的热效应,进行了如下实验(数据为三次取平均值):
实验一
| 试剂1 | 试剂2温度(℃) | 溶解后温度(℃) |
| 0.5g NaHCO3固体 | 10mL水 19.0 | 18.4 |
| 0.5 g Na2CO3固体 | 10mL水 19.0 | 25.5 |
| 试剂1/温度(℃) | 试剂2/温度(℃) | 恰好反应后温度(℃) |
| 含0.5g NaHCO3固体的饱和溶液/19.0 | 6mL稀盐酸/19.0 | 18.3 |
| 含0.5 g Na2CO3固体的饱和溶液/19.0 | 9mL稀盐酸/19.0 | 22.1 |
①通过上述实验可以得出______(填字母编号);
A.NaHCO3的溶解过程表现为吸热
B.NaHCO3的饱和溶液与盐酸反应表现为吸热
C.Na2CO3的溶解过程表现为放热
D.Na2CO3的饱和溶液与盐酸反应表现为吸热
②结论:NaHCO3固体与稀盐酸反应过程中的能量变化与______有关.
解:(1)Na2CO3为强碱弱酸盐,水解呈碱性,发生CO32-+H2O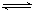 HCO3-+OH-,故答案为:碱性;CO32-+H2O
HCO3-+OH-,故答案为:碱性;CO32-+H2O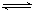 HCO3-+OH-;
HCO3-+OH-;
(2)将0.1mol Na2CO3和0.1mol NaHCO3混合后完全溶于水,离子浓度最大的是Na+,水解呈碱性,且CO32-水解程度大于HCO3-,
则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)Na2CO3滴入几滴水,生成Na2CO3?H2O晶体,为放热反应,盛NaHCO3溶液的试管底部感受不到热量变化,
故答案为:盛Na2CO3溶液的试管底部发热,盛NaHCO3溶液的试管底部感受不到热量变化;
①A.NaHCO3的溶解前后,溶剂温度降低,则过程表现为吸热,故A正确;
B.NaHCO3的饱和溶液与盐酸反应,反应后温度降低,则为吸热反应,故B正确;
C.Na2CO3的溶解后溶液温度升高,则过程表现为放热,故C正确;
D.Na2CO3的饱和溶液与盐酸反应后溶液温度升高,则应为放热反应,故D错误;
故答案为:A、B、C;
②由以上实验可知NaHCO3固体与稀盐酸反应过程中的能量变化与NaHCO3的溶解过程、NaHCO3溶液与盐酸反应的热效应,
故答案为:NaHCO3的溶解过程、NaHCO3溶液与盐酸反应的热效应.
分析:(1)Na2CO3为强碱弱酸盐,水解呈碱性;
(2)将0.1mol Na2CO3和0.1mol NaHCO3混合后完全溶于水,离子浓度最大的是Na+,结合阴离子的水解程度判断;
(3)Na2CO3滴入几滴水,生成Na2CO3?H2O晶体,为放热反应;结合表中数据判断实验前后温度的变化可得出结论.
点评:本题综合考查物质的性质实验的探究,涉及物质的水解、离子浓度大小比较以及实验探究等问题,题目难度中等,注意相关实验数据的分析.
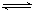 HCO3-+OH-,故答案为:碱性;CO32-+H2O
HCO3-+OH-,故答案为:碱性;CO32-+H2O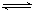 HCO3-+OH-;
HCO3-+OH-;(2)将0.1mol Na2CO3和0.1mol NaHCO3混合后完全溶于水,离子浓度最大的是Na+,水解呈碱性,且CO32-水解程度大于HCO3-,
则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)Na2CO3滴入几滴水,生成Na2CO3?H2O晶体,为放热反应,盛NaHCO3溶液的试管底部感受不到热量变化,
故答案为:盛Na2CO3溶液的试管底部发热,盛NaHCO3溶液的试管底部感受不到热量变化;
①A.NaHCO3的溶解前后,溶剂温度降低,则过程表现为吸热,故A正确;
B.NaHCO3的饱和溶液与盐酸反应,反应后温度降低,则为吸热反应,故B正确;
C.Na2CO3的溶解后溶液温度升高,则过程表现为放热,故C正确;
D.Na2CO3的饱和溶液与盐酸反应后溶液温度升高,则应为放热反应,故D错误;
故答案为:A、B、C;
②由以上实验可知NaHCO3固体与稀盐酸反应过程中的能量变化与NaHCO3的溶解过程、NaHCO3溶液与盐酸反应的热效应,
故答案为:NaHCO3的溶解过程、NaHCO3溶液与盐酸反应的热效应.
分析:(1)Na2CO3为强碱弱酸盐,水解呈碱性;
(2)将0.1mol Na2CO3和0.1mol NaHCO3混合后完全溶于水,离子浓度最大的是Na+,结合阴离子的水解程度判断;
(3)Na2CO3滴入几滴水,生成Na2CO3?H2O晶体,为放热反应;结合表中数据判断实验前后温度的变化可得出结论.
点评:本题综合考查物质的性质实验的探究,涉及物质的水解、离子浓度大小比较以及实验探究等问题,题目难度中等,注意相关实验数据的分析.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
用NA表示阿伏德罗常数,下列叙述正确的是
| A.标准状况下,22.4L H2O含有的分子数为 NA |
| B.常温常压下,1.06g Na2CO3溶于水形成的溶液中含有Na+离子数为0.02 NA |
| C.通常状况下,NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |