题目内容
 Ⅰ.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表.请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线.
Ⅰ.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表.请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线.Ⅱ.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期.X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6.N是短周期主族元素中原子半径最大的非金属元素.
(1)请写出下列元素的元素符号:X
(2)请写出下列反应的离子方程式:N单质与NaOH溶液反应:
(3)Y与Z相比,非金属性较强的元素是
(2)硅能和氢氧化钠反应生成硅酸钠和氢气;
(3)同周期元素的原子,从左到右,元素的非金属性逐渐增强,非金属强的单质可以置换非金属性弱的单质.
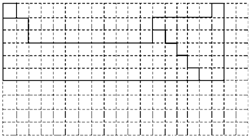
(1)根据题意推断X为氧元素,Z为S元素;X在第二周期,Y与Z同周期,Y在第三周期,则M只能为H元素;Y的最高化合价与最低化合价代数和为6,设最高化合价为a,则最低负化合价为a-8,则a+(a-8)=6,所以a=7,则Y为Cl元素;N为第三周期半径最大的非金属元素,则N为Si,故答案为:O;Cl;H;
(2)硅能和氢氧化钠反应生成硅酸钠和氢气,实质是:Si+2OH-+H2O═SiO32-+2H2↑,故答案为:Si+2OH-+H2O═SiO32-+2H2↑;
(3)同周期元素的原子,从左到右,元素的非金属性逐渐增强,所以S和Cl比较,非金属性较强的元素Cl,氯气能将硫单质置换出来,Cl2+S2-═2Cl-+S↓,故答案为:Cl2+S2-═2Cl-+S↓.

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案㈠下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,请在下面的虚线框中用实线画出周期表的上边框,并画出金属与非金属的分界线。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
㈡.(7分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
|
|
|
|
|
| B |
|
|
|
| D | E | F |
|
|
| C |
|
| G |
|
| H |
|
(1)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________;实验室制取该化合物的化学方程式_________________________
(2)元素G在元素周期表中的位置____________________
(3)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的________(填字母序号)元素组成的,用化学方程式表示吸收原理:
__________________。飞船中消耗1mol该化合物转移电子的物质的量为__________
(4)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
㈠下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,请在下面的虚线框中用实线画出周期表的上边框,并画出金属与非金属的分界线。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
㈡.(7分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
|
|
|
|
|
| B |
|
|
|
| D | E | F |
|
|
| C |
|
| G |
|
| H |
|
(1)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________;实验室制取该化合物的化学方程式_________________________
(2)元素G在元素周期表中的位置____________________
(3)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的________(填字母序号)元素组成的,用化学方程式表示吸收原理:
__________________。飞船中消耗1mol该化合物转移电子的物质的量为__________
(4)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
㈠下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,请在下面的虚线框中用实线画出周期表的上边框,并画出金属与非金属的分界线。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
㈡.(7分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
|
|
|
|
|
| B |
|
|
|
| D | E | F |
|
|
| C |
|
| G |
|
| H |
|
(1)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________;实验室制取该化合物的化学方程式_________________________
(2)元素G在元素周期表中的位置____________________
(3)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的________(填字母序号)元素组成的,用化学方程式表示吸收原理:
__________________。飞船中消耗1mol该化合物转移电子的物质的量为__________
(4)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
㈠下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,请在下面的虚线框中用实线画出周期表的上边框,并画出金属与非金属的分界线。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
㈡.(7分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
|
A |
|
|
|
|
|
|
B |
|
|
|
|
D |
E |
F |
|
|
|
C |
|
|
G |
|
|
H |
|
(1)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________;实验室制取该化合物的化学方程式 _________________________
(2)元素G在元素周期表中的位置____________________
(3)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的________(填字母序号)元素组成的,用化学方程式表示吸收原理:
__________________。飞船中消耗1mol该化合物转移电子的物质的量为__________
(4)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。