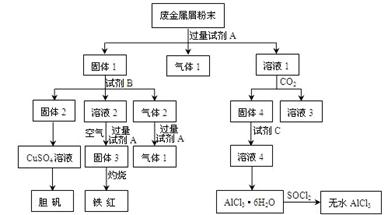
题目内容
合金是建造航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置为________。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为________。
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为____________________________________。
焊接过程中使用的保护气为________(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为________。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为________。

(3)航母螺旋桨主要用铜合金制造。
①80.0 g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0 g,则合金中Cu的质量分数为________。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合题图信息推断该合金中除铜外一定含有________。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置为________。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为________。
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为____________________________________。
焊接过程中使用的保护气为________(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为________。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为________。

(3)航母螺旋桨主要用铜合金制造。
①80.0 g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0 g,则合金中Cu的质量分数为________。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合题图信息推断该合金中除铜外一定含有________。
(1)①第三周期第ⅢA族 CO2 ②Al2O3+2NaOH=2NaAlO2+H2O Ar(其他合理答案均可得分)
(2)①吸氧腐蚀 ②CaCO3或CaO (3)①83.1% ②Al、Ni
(2)①吸氧腐蚀 ②CaCO3或CaO (3)①83.1% ②Al、Ni
本题围绕金属材料命题,要根据题目设问的角度,联系相关知识解答。(1)①Al元素在周期表中的第三周期第ⅢA族;提纯铝土矿通入CO2发生的反应为2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—。②Al2O3与NaOH溶液发生的反应为Al2O3+2NaOH=2NaAlO2+H2O;保护气应不能与金属反应,一般用稀有气体。(2)金属在海水中主要发生吸氧腐蚀;炼钢过程中为降低Si的含量,常加入CaCO3或CaO将SiO2转化为CaSiO3而除去。(3)①因加入过量的氨水会发生反应Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,故得到的白色沉淀为Al(OH)3,物质的量为0.5 mol,据Al元素守恒可知Al的质量为13.5 g,则Cu的质量为66.5 g,Cu的质量分数约为83.1%。②由图像可知,Fe3+在pH≈1.9时开始沉淀,在pH≈3.2时沉淀完全,依次类推。pH=3.4时才开始出现沉淀,说明溶液中没有Fe3+,则一般也无Fe2+,因为Fe2+在空气中会被氧化成Fe3+,此时的沉淀为Al(OH)3;pH=7.0时过滤出的沉淀为Al(OH)3和Cu(OH)2;pH=8.0时过滤出的沉淀为Ni(OH)2。
点拨:知识:金属材料、元素在周期表中的位置、铝的化合物的性质;金属的冶炼与腐蚀;混合物的计算及金属离子沉淀的pH。能力:运用所学相关知识分析问题生解决问题的能力。试题难度:中等。
点拨:知识:金属材料、元素在周期表中的位置、铝的化合物的性质;金属的冶炼与腐蚀;混合物的计算及金属离子沉淀的pH。能力:运用所学相关知识分析问题生解决问题的能力。试题难度:中等。

练习册系列答案
相关题目