��Ŀ����
I�����ݻ���ͬ����������A��B�У������¶�Ϊ423K��ͬʱ��A��B�зֱ����amol��bmol HI ��a��b������Ӧ2HI?H2+I2��g���ﵽƽ����������и����ʵķ�Ӧ����VA VB��ƽ��ʱc��I2��Bƽ��ʱ��I2�����ڻ�������е�����ٷֺ�����A���� B������HI��ƽ��ֽ��ʣ�aA aB���ϳɼ״��ķ�Ӧ��CO��g��+2H2��g��?CH3OH��g������һ���¶��£���һ���ݻ�������ܱ�������ͨ��2.5mol CO��7.5mol H2���ﵽƽ��ʱCO��ת����Ϊ90%����ʱ������ѹǿΪ��ʼʱ�� ����������ͬһ��Ӧ�¶Ƚ���ʼ���ʸ�Ϊa mol CO��b mol H2��c molCH3OH����ʹƽ�������и������ԭƽ����ͬ����a��b����Ĺ�ϵΪ��ϵΪ ������ʹ��ʼʱ���淴Ӧ���淴Ӧ������У�c��ȡֵ��Χ�� ��
����CO��ת��������μӷ�Ӧ��CO�����ʵ��������ò��������ƽ�ⷴӦ�������ܵ����ʵ�����ѹǿ֮�ȵ������ʵ���֮�ȣ�
�������ԭƽ����ͬ˵��Ϊ��Чƽ�⣬���º��ݣ�ǰ����������仯������ѧ������ת������ߣ�����������ʵ����ʵ�����ȼ��ɣ�
�����ƽ��ʱCH3OH��g�������ʵ�����c���ڴ�ֵƽ�����淴Ӧ���У�����ѧ������ת������ߣ��õ�2.5mol COʱc��ֵ���
����⣺I�����ݻ���ͬ����������A��B�У������¶�Ϊ423K��ͬʱ��A��B�зֱ����amol��bmol HI ��a��b������ЧΪa��b�Ļ����Ͽ�ʼ�������ѹǿ����Ӧǰ������������䣬ƽ��ʱ��Ӧ����ֵĺ�����ͬ��HI��ת������ȣ�����a��b��HI��ת������ȣ�ƽ��ʱA��Ũ�ȶ�����B����Ӧ���ʵ�Ũ�ȣ�Ũ��Խ������Խ�������������и����ʵķ�Ӧ����VA��VB��
�ʴ�Ϊ������=��=
��ʼ��Ӧ���������ܵ����ʵ���Ϊ2.5mol+7.5mol=10mol��
ƽ��ʱCO��ת����Ϊ90%�����Բμӷ�ӦCO�����ʵ���Ϊ2.5mol×90%=2.25mol��
���ڷ�Ӧ CO��g��+2H2��g��
 CH3OH��g�������ʵ������١�n
CH3OH��g�������ʵ������١�n1mol 2mol
2.25mol 4.5mol
����ƽ���Ӧ���������ܵ����ʵ���Ϊ2.5mol+7.5mol-4.5mol=5.5mol
ѹǿ֮�ȵ������ʵ���֮�ȣ����Դ�ʱ������ѹǿΪ��ʼʱ�ı���Ϊ
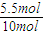 =0.55��
=0.55���������ԭƽ����ͬ˵��Ϊ��Чƽ�⣬���º��ݣ�ǰ����������仯������ѧ������ת������ߣ�����������ʵ����ʵ�����ȼ��ɣ�������
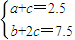 �����2a+2.5=b��
�����2a+2.5=b�����ڷ�Ӧ CO��g��+2H2��g��
 CH3OH��g����
CH3OH��g������ʼ��mol����2.5 7.5 0
�仯��mol����2.25 4.5 2.25
ƽ�⣨mol����0.25 3 2.25
ƽ��ʱCH3OH�����ʵ���Ϊ2.25mol������c��2��25molƽ�����淴Ӧ���У�����ѧ������ת������ߣ��õ�2.5mol COʱc��ֵ�������c���Ϊ2.5mol������2.25��c��2.5��
�ʴ�Ϊ��0.55��2a+2.5=b��2.25��c��2.5��
����������ƽ����㡢��Чƽ��ȣ��ѶȽϴ�ע���Ч˼��������Լ����ü�����ȷ��c��ȡֵ��Χ��

��15�֣�������һ����Ҫ�Ļ���ԭ�ϣ����������������ء�����̬�����Լ����ᣬ���л��ϳɹ�ҵ���ƺϳ���ά�����ϡ�Ⱦ�ϵȡ���ش��������⣺
��1�������ǹ�ҵ�Ʊ��������Ҫԭ�ϣ���֪���������Ȼ�ѧ����ʽ��
�� N2 (g)+ 3H2 (g) 2NH3 (g) ��H1
2NH3 (g) ��H1
�� 4NH3(g) +5O2 (g)�� 4NO(g) +6H2O(l) ��H2
�� N2 (g)+ O2 (g)�� 2NO (g) ��H
�ܷ�Ӧ�á�H1�͡�H2��ʾ��H��
�����á�H1�͡�H2��ʾ��H����д����H= �������ܣ�˵�����ɣ�
��
��2������ͬ���¶��£��ݻ���ȵ����������ܱ���������ŷֱ�Ϊa��b���У�һ�����ĵ����������������п��淴Ӧ��
N2(g) �� 3H2(g)  2NH3(g) ��H����92.4 kJ/mol
2NH3(g) ��H����92.4 kJ/mol
ʵ���÷�Ӧ��ʼʱ�����ʵ����ʵ�����ƽ��ʱ�ų����������±���
| ������� | ��ʼʱ���������ʵ���/mol | ƽ��ʱ��Ӧ | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | δ֪����E��ʾ�� |
�ٷ�Ӧa�ͷ�Ӧb������ת������ͬ
��������֪���ݿ��Լ��㷴Ӧb��ƽ�ⳣ��
��������֪���ݿ��Լ��㷴Ӧb�ų�������E
��ƽ��ʱa��b������Ӧ�İ����������Ϊ1:1
��3���¶�Ϊ400�桢ѹǿΪ30Mpa������£��ܱ������з��������뵪���ĺϳɰ���Ӧ��N2(g)+3H2(g)
 2NH3(g) ��H��0 ��
2NH3(g) ��H��0 �����������ʵ���[n(NH3)]�����������ʵ���[n(H2)]��ʱ��仯�Ĺ�ϵ����ͼ��

����Ӧ�������ĵ��� ��ѡ��a��b��c��d�е�һ�����������������ʵ���[n(N2)]��ȵ������� ��ѡ��a��b��c��d�е������������������������䣬���¶ȸ�Ϊ600�棬����ͼ�л�����Ӧ�ﵽƽ��Ĺ����а����ı仯���ߡ�
��4����ҵ�ϳɰ���ú�Ʊ�ԭ��������ʱ�������ŷŴ����Ķ�����̼��ʵ�ʹ�ҵ�����п����ö�����̼�������������ѣ�CH3OCH3����һ�������£����ݻ��̶����ܱ��豸�з�����Ӧ��
2CO2(g)��6H2(g)
 CH3OCH3(g)��3H2O(g) ��H��0
CH3OCH3(g)��3H2O(g) ��H��0�����ܱպ������������¶Ⱦ�ΪT�ұ��ֲ��������½���������Ӧ��һ��ʱ����������������й����ݼ����淴Ӧ���ʹ�ϵ���±���
| ���� | c(CO2) /mol��L��1 | c(H2) /mol��L��1 | c(CH3OCH3) /mol��L��1 | c(H2O) /mol��L��1 | v (��)��v (��)�Ƚ� |
| ����I | 1.0��10��2 | 1.0��10��2 | 1.0��10��4 | 1.0��10��4 | v (��)��v (��) |
| ����II | 2.0��10��2 | 1.0��10��2 | 1.0��10��4 | 2.0��10��4 | |
��15�֣�������һ����Ҫ�Ļ���ԭ�ϣ����������������ء�����̬�����Լ����ᣬ���л��ϳɹ�ҵ���ƺϳ���ά�����ϡ�Ⱦ�ϵȡ���ش��������⣺
��1�������ǹ�ҵ�Ʊ��������Ҫԭ�ϣ���֪���������Ȼ�ѧ����ʽ��
�� N2 (g)+ 3H2
(g)  2NH3 (g) ��H1
2NH3 (g) ��H1
�� 4NH3(g) +5O2 (g)�� 4NO(g) +6H2O(l) ��H2
�� N2 (g)+ O2 (g)�� 2NO (g) ��H
�ܷ�Ӧ�á�H1�͡�H2��ʾ��H��
�����á�H1�͡�H2��ʾ��H����д����H= �������ܣ�˵�����ɣ�
��
��2������ͬ���¶��£��ݻ���ȵ����������ܱ���������ŷֱ�Ϊa��b���У�һ�����ĵ����������������п��淴Ӧ��
N2(g)
�� 3H2(g)
 2NH3(g) ��H����92.4 kJ/mol
2NH3(g) ��H����92.4 kJ/mol
ʵ���÷�Ӧ��ʼʱ�����ʵ����ʵ�����ƽ��ʱ�ų����������±���
|
������� |
��ʼʱ���������ʵ���/mol |
ƽ��ʱ��Ӧ |
||
|
N2 |
H2 |
NH3 |
||
|
a |
1 |
3 |
0 |
23.1 |
|
b |
2 |
6 |
0 |
δ֪����E��ʾ�� |
����˵����ȷ���� ������ţ�
�� ��Ӧa�ͷ�Ӧb������ת������ͬ
��������֪���ݿ��Լ��㷴Ӧb��ƽ�ⳣ��
��������֪���ݿ��Լ��㷴Ӧb�ų�������E
��ƽ��ʱa��b������Ӧ�İ����������Ϊ1:1
��3���¶�Ϊ400�桢ѹǿΪ30Mpa������£��ܱ������з��������뵪���ĺϳɰ���Ӧ��N2(g)+3H2(g)  2NH3(g)
��H��0 ��
2NH3(g)
��H��0 ��
���������ʵ���[n(NH3)]�����������ʵ���[n(H2)]��ʱ��仯�Ĺ�ϵ����ͼ��

����Ӧ�������ĵ��� ��ѡ��a��b��c��d�е�һ�����������������ʵ���[n(N2)]��ȵ������� ��ѡ��a��b��c��d�е������������������������䣬���¶ȸ�Ϊ600�棬����ͼ�л�����Ӧ�ﵽƽ��Ĺ����а����ı仯���ߡ�
��4����ҵ�ϳɰ���ú�Ʊ�ԭ��������ʱ�������ŷŴ����Ķ�����̼��ʵ�ʹ�ҵ�����п����ö�����̼�������������ѣ�CH3OCH3����һ�������£����ݻ��̶����ܱ��豸�з�����Ӧ��
2CO2(g)��6H2(g) CH3OCH3(g)��3H2O(g) ��H��0
CH3OCH3(g)��3H2O(g) ��H��0
�����ܱպ������������¶Ⱦ�ΪT�ұ��ֲ��������½���������Ӧ��һ��ʱ����������������й����ݼ����淴Ӧ���ʹ�ϵ���±���
|
���� |
c(CO2) /mol��L��1 |
c(H2) /mol��L��1 |
c(CH3OCH3) /mol��L��1 |
c(H2O) /mol��L��1 |
v (��)��v (��)�Ƚ� |
|
����I |
1.0��10��2 |
1.0��10��2 |
1.0��10��4 |
1.0��10��4 |
v (��)��v (��) |
|
����II |
2.0��10��2 |
1.0��10��2 |
1.0��10��4 |
2.0��10��4 |
|
����I�еķ�Ӧ (ѡ��ǡ���)�ﵽƽ��״̬���÷�Ӧ���¶�ΪTʱ��ƽ�ⳣ��K= �������ڵĿո�v(��)��v(��)�Ĵ�С��ϵ�� ��