题目内容
【题目】将7.8克镁和铝的混合粉末溶于900ml浓度为1mol/L的盐酸中,完全反应可收集到标准状况下气体8.96升,向反应后的混合溶液中逐滴加入2mol/L的氢氧化钠溶液,试计算:
(1)原金属混合物中含铝___g;
(2)当加入___mL氢氧化钠溶液时,Mg2+、Al3+恰好完全沉淀;
(3)当再加入___mL氢氧化钠溶液时,Al(OH)3恰好完全溶解,此时可得沉淀__克。
【答案】5.4 450 100 5.8
【解析】
7.8克镁和铝的混合粉,设镁和铝的物质的量分别为xmol和ymol,根据Mg~H2,2Al~3H2的关系式,列出24x+27y=7.8,x+![]() y=
y=![]() ,解之得x=0.1mol;y=0.2mol,由此分析解答。
,解之得x=0.1mol;y=0.2mol,由此分析解答。
7.8克镁和铝的混合粉,设镁和铝的物质的量分别为xmol和ymol,得到氢气的物质的量为:![]() =0.4mol,则24x+27y=7.8,x+
=0.4mol,则24x+27y=7.8,x+![]() y=0.4,解之得x=0.1mol;y=0.2mol,
y=0.4,解之得x=0.1mol;y=0.2mol,
(1)原金属混合物中含铝的质量为:0.2mol×27g/mol=5.4g;
(2)Mg2+、Al3+恰好完全沉淀,得到单一溶质氯化钠,根据氯化钠的组成,n(NaOH)=n(HCl)=0.9L×1mol/L=0.9mol,所以氢氧化钠溶液体积为:![]() =0.45L=450mL;
=0.45L=450mL;
(3)氢氧化铝的物质的量等于铝的物质的量,而氢氧化铝恰好完全溶解发生的反应为Al(OH)3+NaOH═NaAlO2+2H2O,所以溶解需氢氧化钠的物质的量为0.2mol,所以消耗氢氧化钠的体积为![]() =0.1L=100mL,所以再加入100ml氢氧化钠溶液时,Al(OH)3恰好完全溶解,氢氧化镁不溶解,根据Mg元素守恒,此时可得0.1mol的氢氧化镁沉淀,质量为:0.1mol×58g/mol =5.8g。
=0.1L=100mL,所以再加入100ml氢氧化钠溶液时,Al(OH)3恰好完全溶解,氢氧化镁不溶解,根据Mg元素守恒,此时可得0.1mol的氢氧化镁沉淀,质量为:0.1mol×58g/mol =5.8g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列各组物质中,不能按如图所示![]() “
“![]() ”表示一步完成
”表示一步完成![]() 关系相互转化的是( )
关系相互转化的是( )
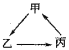
A | B | C | D | |
甲 | Al | Na | SO2 | Cu |
乙 | NaAlO2 | NaOH | SO3 | CuO |
丙 | Al(OH)3 | NaCl | H2SO4 | CuCl2 |
A.AB.BC.CD.D
【题目】下列物质的分离提纯中除杂剂及相应的化学方程式分别为:
混合物成分 | 除杂试剂 | 化学方程式 |
(i)铜粉中混有铁粉 | __ | __ |
(ii)铁粉中混有铝粉 | __ | __ |
(iii)Al2O3中混有Al(OH)3 | __ | __ |
(iv)FeCl3溶液中混有FeCl2 | __ | __ |