题目内容
将NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液并用水溶解、加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应.则X为( )
分析:NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液加热时发生氧化还原反应,利用氧化还原反应中电子守恒来分析.
解答:解:因NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液加热时发生氧化还原反应,
Cl元素的化合价降低,S元素的化合价升高,
Na2SO3作还原剂,S元素的化合价由+4价升高为+6价,
设X中Cl元素的化合价为x,由电子守恒可知,
2×(5-x)=1×(6-4),解得x=+4,
A、ClO2中,O为-2价,由化合物中正负化合价的代数和为0,则Cl为+4价,故A正确;
B、Cl2O中,O为-2价,由化合物中正负化合价的代数和为0,则Cl为+1价,故B错误;
C、Cl2中,Cl元素的化合价为0,故C错误;
D、Cl2O3中,O为-2价,由化合物中正负化合价的代数和为0,则Cl为+3价,故D错误;
故选A.
Cl元素的化合价降低,S元素的化合价升高,
Na2SO3作还原剂,S元素的化合价由+4价升高为+6价,
设X中Cl元素的化合价为x,由电子守恒可知,
2×(5-x)=1×(6-4),解得x=+4,
A、ClO2中,O为-2价,由化合物中正负化合价的代数和为0,则Cl为+4价,故A正确;
B、Cl2O中,O为-2价,由化合物中正负化合价的代数和为0,则Cl为+1价,故B错误;
C、Cl2中,Cl元素的化合价为0,故C错误;
D、Cl2O3中,O为-2价,由化合物中正负化合价的代数和为0,则Cl为+3价,故D错误;
故选A.
点评:本题考查氧化还原反应中电子守恒的计算,明确硫元素的化合价升高,氯元素的化合价降低是解答本题的关键.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
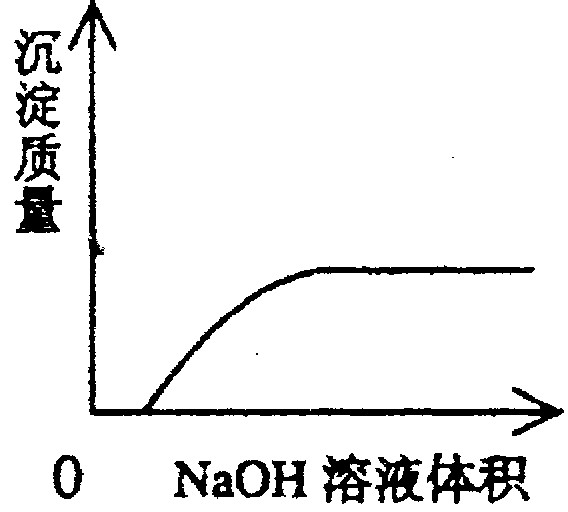
将过量的氯气通入30mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3的共存体系.下列判断正确的是( )
| A、与NaOH反应的氯气一定为0.15 mol | B、当反应中被氧化的氯元素和被还原的氯元素之比为1:4时,溶液中NaClO和NaClO3的物质的量之比为3:1 | C、溶液中n(Na+):n(Cl-)可能为7:3 | D、若Cl2与NaOH的反应中转移的电子为n mol,则0.15<n<0.35 |


 B、
B、
 D、
D、