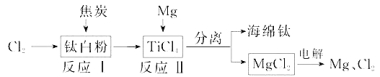
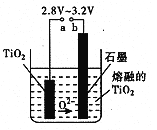
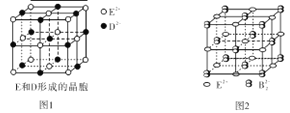
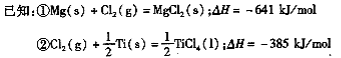题目内容
【题目】某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质的成分。

(1)写出装置A中发生反应的化学方程式: 。
(2)装置B的主要作用是 。
(3)向C装置中通入一定量的氯气后,测得只生成一种气体(常温下为棕黄色,且为氯的氧化物)。可以确定的是C得到的固体最多含有三种物质,含有氯元素的盐只有一种,且含有NaHCO3,现对C中得到的固体成分进行猜想和验证。
① 提出合理猜想一定含有NaHCO3和 ;可能含有剩余的Na2CO3。
② 设计方案,进行成分检验。请完成实验步骤3、4以及预期现象和结论
限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸。
1、实验步骤 | 2、预期现象和结论 |
3、步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于甲、乙两支试管中。 | 4、得到无色溶液 |
5、步骤2:向甲试管中加入过量的BaCl2溶液,静置 | 6、若溶液变浑浊,证明固体中含碳酸钠。 |
7、步骤3: | 8、 |
9、步骤4: | 10、 |
(4)完成C中反应的化学方程式:2Cl2+2Na2CO3+H2O= 。
【答案】(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)除去Cl2中混有的HCl气体
(3)①NaCl ②
实验步骤 | 预期现象和结论 |
步骤3:向甲中上层清液中滴入少量澄清石灰水 | 若上层清液变浑浊,证明固体中含有碳酸氢钠 |
步骤4:向乙试管中加入过量的稀HNO3,再滴入少量AgNO3溶液 | 若生成白色沉淀,证明固体中含有氯化钠 |
(4)2NaHCO3+NaCl+Cl2O(3分)
【解析】
试题分析:(1)A装置是制备氯气的,所以X试剂是浓盐酸,反应的化学方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)由于浓盐酸易挥发,所以生成的氯气中含有氯化氢,而氯化氢能和碳酸钠反应,所以需要除去氯气中的氯化氢。
(3)①由潮湿的氯气与Na2CO3发生的反应,结合已知信息来提出自己的假设。因产物中只有一种常温下为棕黄色的含氯氧化物气体,该含氯氧化物中氯元素的化合价应为正价,则产物中含氯元素的盐只能为NaCl。假设存在两种成分,为NaHCO3和NaCl;假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3;
②步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3。步骤3应是检验碳酸氢钠的,操作为向甲中上层清液中滴入少量澄清石灰水,若上层清液变浑浊,证明固体中含有碳酸氢钠;步骤4应是检验氯离子,应向乙试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl。
(5)根据电子得失守恒可知,氧化产物中氯元素的化合价应该是+1价,所以其氧化产物是Cl2O,即C中反应生成的含氯氧化物为Cl2O,反应的方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+NaCl+Cl2O。