题目内容
草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性.在常温下10mLpH=10 的KOH溶液中,加入pH=4的H2C2O4溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是( )
| A.C(K+)+C(H+)=C(HC2O4?)+C(OH?)+C(C2O42-) |
| B.C(K+)=C(HC2O4?)+2C(C2O42-) |
| C.C(K+)=C(H2C2O4)+C(HC2O4?)+C(C2O42-) |
| D.V总≧20mL |
A.溶液呈电中性,所以(K+)+C(H+)=C(HC2O4?)+C(OH?)+2C(C2O42-),故A错误;
B.混合溶液的pH=7,则溶液中C(H+)=C(OH?),溶液呈电中性,所以C(K+)=C(HC2O4?)+2C(C2O42-),故B正确;
C.混合溶液的pH=7,则溶液中C(H+)=C(OH?),溶液呈电中性,所以C(K+)=C(HC2O4?)+2C(C2O42-),故C错误;
D.pH=4的H2C2O4溶液中C(H2C2O4)>5×10-5 mol/L,pH=10的氢氧化钾溶液中,C(KOH)=10-4 mol/L,要中和10mLpH=10 的KOH溶液使溶液呈中性,则加入的草酸溶液的体积<10mL,所以V总<20mL,故D错误;
故选B.
B.混合溶液的pH=7,则溶液中C(H+)=C(OH?),溶液呈电中性,所以C(K+)=C(HC2O4?)+2C(C2O42-),故B正确;
C.混合溶液的pH=7,则溶液中C(H+)=C(OH?),溶液呈电中性,所以C(K+)=C(HC2O4?)+2C(C2O42-),故C错误;
D.pH=4的H2C2O4溶液中C(H2C2O4)>5×10-5 mol/L,pH=10的氢氧化钾溶液中,C(KOH)=10-4 mol/L,要中和10mLpH=10 的KOH溶液使溶液呈中性,则加入的草酸溶液的体积<10mL,所以V总<20mL,故D错误;
故选B.

练习册系列答案
相关题目
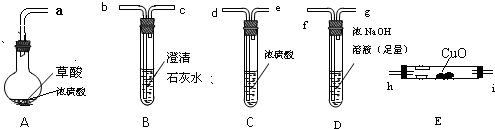
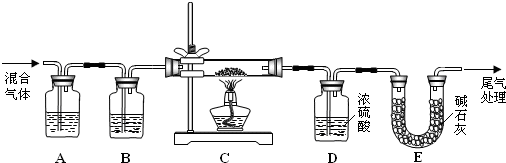
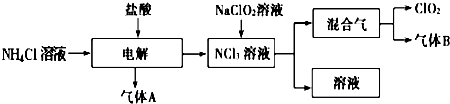
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.