题目内容
7.某双原子分子构成的气体,质量为m g,所含原子个数为N个,阿伏加德罗常数的值为NA,则:(1)该气体的物质的量为$\frac{n}{M}$ mol.
(2)该气体在标准状况下的体积为$\frac{11.2N}{{N}_{A}}$ L.
(3)该气体的摩尔质量为$\frac{2m{N}_{A}}{N}$ g/mol,
(4)该气体的一个分子的质量为$\frac{M}{{N}_{A}}$g.
分析 (1)利用n=$\frac{m}{M}$来计算;
(2)利用n=$\frac{m}{M}$、V=n×Vm来计算;
(3)气体的摩尔质量在数值上等于其相对分子质量;
(4)摩尔质量为M g•mol-1,即NA个分子的质量为Mg,来计算一个分子的质量.
解答 解:(1)气体的摩尔质量为Mg•mol-1,该气体质量为mg,该气体的物质的量为$\frac{n}{M}$mol,故答案为:$\frac{n}{M}$;
(2)气体的物质的量为:$\frac{N}{2{N}_{A}}$mol,则该气体在标准状况下的体积约为$\frac{N}{2{N}_{A}}$mol×22.4L/mol=$\frac{11.2N}{{N}_{A}}$L,故答案为:$\frac{11.2N}{{N}_{A}}$L;
(3)双原子分子构成的气体,质量为m g,所含原子个数为N个,阿伏加德罗常数的值为NA,气体的物质的量为:$\frac{N}{2{N}_{A}}$mol,所以$\frac{N}{2{N}_{A}}$mol=$\frac{m}{M}$,所以M=$\frac{2m{N}_{A}}{N}$g/mol,
故答案为:$\frac{2m{N}_{A}}{N}$;
(4)摩尔质量为M g•mol-1,即NA个分子的质量为Mg,则一个分子的质量为$\frac{M}{{N}_{A}}$g,故答案为:$\frac{M}{{N}_{A}}$.
点评 本题考查有关物质的量、阿伏伽德罗常数的计算,明确质量、体积、物质的量的关系即可解答,并注意摩尔质量的意义来计算.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
18.关于下列图象及其相关说法正确的是( )
| A. |  根据图可判断:2O3(g)=3O2(g);△H=-44.8KJ/mol | |
| B. |  根据图可判断A(g)?2C(g)在使用催化剂时的反应速率大,且面积Saco>Sbdo | |
| C. | 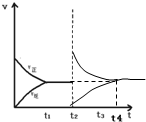 根据图可判断2A(g)?C(g)在恒温恒压时再充入A(g),t4重新达到平衡时与上一平衡为等效平衡 | |
| D. |  图表示2NO2(g)?N2O4(g)反应,当其它条件相同时,改变压强达到平衡时C(NO2)变化情况,且P1>P2 |
15.下列说法中,正确的是( )
| A. | 冰融化是化学变化 | B. | 电解水的过程是物理变化 | ||
| C. | 植物的光合作用是化学变化 | D. | 焰色反应是化学变化 |
2.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25 NA | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
12.常温下,四个容积均为20L的容器中分别装有下列气体,产生的压强最大的是( )
| A. | 5 克 H2 | B. | 24 克HCl | C. | 48克SO2 | D. | 55克CO2 |
19.化学实验必须注意安全,下列做法存在安全隐患的是( )
| A. | 氢气还原氧化铜实验中,先通氢气后加热氧化铜 | |
| B. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| D. | 在制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞 |
1.将X和Y加入密闭容器中,在一定条件下发生反应:X(g)+Y(s)?2Z(g)+W(s).忽略固体所占体积,平衡时Z的体积分数(%)随温度和压强的变化如表所示.
请回答下列问题:
(1)该反应的△S>(填“>”、“<”或“=”,下同)0;△H>0.
(2)表中该反应的化学平衡常数的值最大时对应的温度是1000℃;判断理由是该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大.
(3)在915℃、2.0MPa时X的平衡转化率为60%.
(4)用压强替代浓度得到的平衡常数叫作压强平衡常数(Kp).在810℃、1.0MPa下,Kp=0.634MPa.
(5)能同时提高X的反应速率和转化率的措施是A.
A.升高温度 B.增大压强 C.加催化剂 D分离Z.
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 85.0 |
(1)该反应的△S>(填“>”、“<”或“=”,下同)0;△H>0.
(2)表中该反应的化学平衡常数的值最大时对应的温度是1000℃;判断理由是该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大.
(3)在915℃、2.0MPa时X的平衡转化率为60%.
(4)用压强替代浓度得到的平衡常数叫作压强平衡常数(Kp).在810℃、1.0MPa下,Kp=0.634MPa.
(5)能同时提高X的反应速率和转化率的措施是A.
A.升高温度 B.增大压强 C.加催化剂 D分离Z.
 A,B,C,D,E是原子序数依次增大的五种短周期元素,A是半径最小的元素,C是半径最大的元素.B和D分别为同主族,且D的质子数是B的2倍,A与E形成的化合物的化学式为AE,其分子中含18个电子,请回答下列问题:
A,B,C,D,E是原子序数依次增大的五种短周期元素,A是半径最小的元素,C是半径最大的元素.B和D分别为同主族,且D的质子数是B的2倍,A与E形成的化合物的化学式为AE,其分子中含18个电子,请回答下列问题: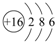 .
.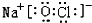 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.