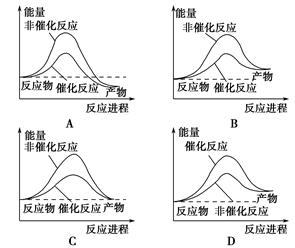
题目内容
反应A(g)+B(g)→C(g) ΔH分两步进行:①A(g)+B(g)→X(g)ΔH1 ②X(g)→C(g) ΔH2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )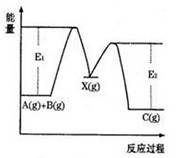
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
A
解析

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)与 O2(g)反应生成NO(g)过程中的能量变化:
下列说法正确的是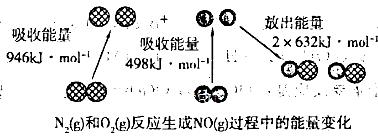
| A.1 mol N2(g)和1 molO2 (g)具有的总能量大于 2 mol NO(g)具有的总能量 |
| B.1 molN2 (g)和l molO2 (g)反应生成2 mol NO(g)吸收180 kJ热量. |
| C.通常情况下N2(g)和O2(g)混合能直接反应生成NO |
| D.数据不足,不能确定反应热的大小 |
下列有关化学反应与能量的说法正确的是
| A.酸碱中和是放热反应 |
| B.炭在二氧化碳气体中灼烧发生的反应属于放热反应 |
| C.原子间形成化学键时需吸收能量 |
| D.化学反应过程中,化学能一定全部转化成热能 |
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗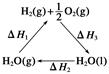 |
| B.该过程实现了太阳能向化学能的转化 |
| C.图中ΔH1=ΔH2+ΔH3 |
| D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O |
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是 ( )。
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: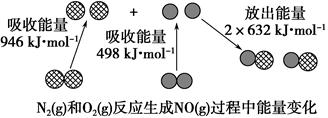
下列说法正确的是( )。
| A.1 mol N2(g)和1 mol O2(g)反应吸收的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
如图所示,图像表示某一反应过程中的能量变化曲线。下列说法中不正确的是( )
| A.由图可知,该反应为放热反应 |
| B.该反应的焓变为ΔH=-(E2-E1) |
| C.曲线b相对曲线a来说,改变的条件只能是使用了催化剂 |
| D.该反应的发生条件一定是加热 |
已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |