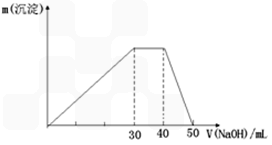
题目内容
 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)(1)E、G、M的第一电离能由大到小的顺序为
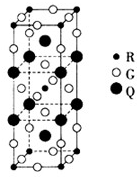
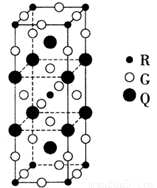
(2)如图所示是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价.基态R2+的核外电子排布式为
(3)1mol晶体L中含有δ键的数目为
(4)G与M可形成MG3与MG2,MG3分子的空间构型是
(5)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有
a.离子键 b. 氢键 c.配位键 d.金属键.
分析:A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,则A为氢元素;D、G、L、M基态原子的最外能层均有2个未成对电子,外围电子排布为ns2np2或ns2np4,故D为碳元素、G为氧元素、L为Si元素、M为硫元素;E介于碳元素与氧元素之间,故E为氮元素;R+核外有28个电子,则R元素原子质子数为29,故R为Cu,据此解答.
解答:解:A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,则A为氢元素;D、G、L、M基态原子的最外能层均有2个未成对电子,外围电子排布为ns2np2或ns2np4,故D为碳元素、G为氧元素、L为Si元素、M为硫元素;E介于碳元素与氧元素之间,故E为氮元素;R+核外有28个电子,则R元素原子质子数为29,故R为Cu,
(1)非金属性越强第一电离能越大,但N元素原子2p能级容纳3个电子,为半满稳定状态,电子能量较低,第一电离能高于氧元素,故第一电离能由大到小的顺序为N>O>S,故答案为:N>O>S;
(2)R为Cu,基态Cu2+的核外电子排布式为1s22s22p63s23p63d9.晶胞结构中R原子数目为1+8×
=2,G原子数目为2+4×
+16×
=8,Q原子数目为2+8×
=4,令Q的化合价为a,则4a+2×2+8×(-2)=0,解得a=3,故Q的化合价为+3,
故答案为:1s22s22p63s23p63d9;+3;
(3)晶体Si属于原子晶体,晶体中每个Si原子成4个Si-Si键,每个Si-Si键给1个Si提供
,故1mol晶体硅中含有δ键的数目为1mol×4×
×NAmol-1=2NA,
故答案为:2NA;
(4)SO3中S原子价层电子对数为3+
=3,S原子采取sp2杂化,孤电子对为0,为平面三角形;SO2中S原子价层电子对数为2+
=3,S原子采取sp2杂化,
故答案为:平面三角形;sp2杂化;
(5)在(NH4)2Cu(SO4)2中存在的化学键除极性键外,[(NH4)2Cu]4+与SO42-之间存在离子键,[(NH4)2Cu]4+中铵根离子与铜离子之间形成配位键,
故答案为:ac.
(1)非金属性越强第一电离能越大,但N元素原子2p能级容纳3个电子,为半满稳定状态,电子能量较低,第一电离能高于氧元素,故第一电离能由大到小的顺序为N>O>S,故答案为:N>O>S;
(2)R为Cu,基态Cu2+的核外电子排布式为1s22s22p63s23p63d9.晶胞结构中R原子数目为1+8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 4 |
故答案为:1s22s22p63s23p63d9;+3;
(3)晶体Si属于原子晶体,晶体中每个Si原子成4个Si-Si键,每个Si-Si键给1个Si提供
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:2NA;
(4)SO3中S原子价层电子对数为3+
| 6-2×3 |
| 2 |
| 6-2×2 |
| 2 |
故答案为:平面三角形;sp2杂化;
(5)在(NH4)2Cu(SO4)2中存在的化学键除极性键外,[(NH4)2Cu]4+与SO42-之间存在离子键,[(NH4)2Cu]4+中铵根离子与铜离子之间形成配位键,
故答案为:ac.
点评:本题考查核外电子排布规律、电离能、晶胞、杂化理论、化学键等,难度中等,推断元素是解题的关键,(2)中晶胞计算为易错点,注意仔细观察结构.

练习册系列答案
相关题目
 NaCl +D
NaCl +D

 NaCl +D
NaCl +D