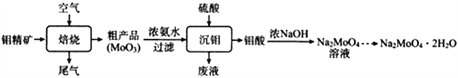
ћвƒњƒЏ»Ё
°Њћвƒњ°њовЋбƒ∆ЊІће(Na2MoO4°§2H2O)њ…“÷÷∆љр фЄѓ і°£“‘овЊЂњу(÷ч“™≥…Ј÷ќ™MoS2£ђЇђ…ўЅњ‘”÷ )ќ™‘≠Ѕѕ£ђ÷∆±ЄовЋбƒ∆ЊІћеµƒ÷ч“™Ѕч≥ћЌЉ»зѕ¬°£
їЎірѕ¬Ѕ–ќ ћв
£®1£©Ќк≥…ѕ¬Ѕ–Јі”¶£Ї_____MoS2+ _____O2![]() _____SO2+ _____MoO3
_____SO2+ _____MoO3
‘Џ±Ї…’¬ѓ÷–£ђњ’∆ші”¬ѓµ„љш»лњу ѓЊ≠ЈџЋйЇуі”¬ѓґ•љш»л£ђ’в—щі¶јнµƒƒњµƒ «__________________°£
£®2£©≈®∞±ЋЃљю»°і÷≤ъ∆Јїсµ√(NH4)2MoO4»№“Ї£ђ∆дїѓ—ІЈі”¶Јљ≥ћ љќ™____________________________£їЄ√Јі”¶Ћµ√чMoO3______£®ћо°∞”–°±їт°∞√ї”–°±£©Ћб–‘—хїѓќпµƒ–‘÷ °£
£®3£©≥£ќ¬ѕ¬£ђ≥Ѕовљ„ґќЋщµ√Јѕ“Їќ™(NH4)2SO4ѕ°»№“Ї°£»ф(NH4)2SO4ѕ°»№“ЇµƒpH=a£ђ‘т![]() =_______£®”√Їђaµƒіъ э љ±н Њ£ђNH3°§H2OµƒKb=1.8°Ѕ10-5£©£ђ»фљЂіЋѕ°»№“Ї’фЈҐ≈®Ћх£ђ
=_______£®”√Їђaµƒіъ э љ±н Њ£ђNH3°§H2OµƒKb=1.8°Ѕ10-5£©£ђ»фљЂіЋѕ°»№“Ї’фЈҐ≈®Ћх£ђ![]() љЂ_________£®ћо°∞±діу°±°∞≤ї±д°±їт°∞±д–°°±£©°£
љЂ_________£®ћо°∞±діу°±°∞≤ї±д°±їт°∞±д–°°±£©°£
£®4£©“—÷™овЋбƒ∆‘Џ“їґ®ќ¬ґ»ЈґќІƒЏµƒќц≥цќп÷ Љ∞ѕа”¶ќп÷ µƒ»№љвґ»»зѕ¬±нЋщ Њ£ђїсµ√Na2MoO4°§2H2Oµƒ≤ў„чќ™_____________°£
ќ¬ґ»(°ж) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |
ќц≥цќп÷ | Na2MoO4°§10H2O | Na2MoO4°§2H2O | ||||||
»№љвґ» | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45. |
љбЊІµ√µљµƒƒЄ“Їњ…“‘‘Џѕ¬іќљбЊІ ±÷ЎЄі є”√£ђµЂіпµљ“їґ®іќ эЇу±Ў–лЊїїѓі¶јн£ђ‘≠“т «_____________°£
£®5£©њ’∆ш÷–овЋб—ќґ‘ћЉЄ÷µƒїЇ і‘≠јн «‘ЏЄ÷ћъ±н√ж–ќ≥…FeMoO4-Fe2O3±£ї§ƒ§£ђ‘Џ√№±’ љ—≠їЈјд»іЋЃѕµЌ≥÷–µƒћЉЄ÷є№µјїЇ і£ђ≥э–иЉ”»ловЋб—ќЌвїє–иЉ”»лµƒќп÷ «___________(ћо—°ѕо„÷ƒЄ)°£
A. NaNO2 B.Ќ®»л ЅњN2 C.”Ќ÷ђ D.—ќЋб
°Њір∞Є°њ 2 7 4 2 ‘ціуєћ∆шљ”і•√жїэ£ђћбЄя‘≠Ѕѕјы”√¬ (Љ”њмЈі”¶Ћў¬ “ањ…) MoO3+2NH3°§H2O=(NH4)2MoO4+H2O ”– 1.8°Ѕ109-a ±діу ’фЈҐ≈®Ћх£ђњЎ÷∆‘Џ15.5°ж“‘…ѕ(їт15.5 °ж~100°ж)љш––єэ¬Ћ(ѕіµ”°ҐЅјЄ…) ƒЄ“Ї÷–µƒNaOH≈®ґ»‘љјі‘љіу£ђ„оЇуљбЊІћбіњ ±ЋжNa2MoO4°§2H2Oќц≥ц A
°Њљвќц°њ£®1£©ЄщЊЁ—хїѓїє‘≠Јі”¶їѓЇѕЉџ…эљµѕаµ»єж¬…£ЇMo”…+4Љџ…эЄяµљ+6Љџ£ђS”…-2Љџ…эЄя+4Љџ£ђє≤…эЄя[6-4+2°Ѕ£®4+2£©]=14Љџ£ђO”…0ЉџљµµЌµљ-2Љџ£ђє≤љµµЌ4Љџ£ђ„о–°єЂ±ґ эќ™28£їЋщ“‘MoS2ѕµ эќ™2£ђO2ѕµ э7£ђЄщЊЁ‘≠„” ЎЇгљш––≈д∆љ£ђЊяће»зѕ¬£Ї2MoS2+7O2![]() 4SO2+ 2MoO3£ї‘Џ±Ї…’¬ѓ÷–£ђњ’∆ші”¬ѓµ„љш»лњу ѓЊ≠ЈџЋйЇуі”¬ѓґ•љш»л£ђњ…“‘‘ціуєћ∆шљ”і•√жїэ£ђћбЄя‘≠Ѕѕјы”√¬ £ђЉ”њмЈі”¶Ћў¬ £ї’э»Јір∞Є£Ї2 7 4 2£ї‘ціуєћ∆шљ”і•√жїэ£ђћбЄя‘≠Ѕѕјы”√¬ (Љ”њмЈі”¶Ћў¬ “ањ…)°£
4SO2+ 2MoO3£ї‘Џ±Ї…’¬ѓ÷–£ђњ’∆ші”¬ѓµ„љш»лњу ѓЊ≠ЈџЋйЇуі”¬ѓґ•љш»л£ђњ…“‘‘ціуєћ∆шљ”і•√жїэ£ђћбЄя‘≠Ѕѕјы”√¬ £ђЉ”њмЈі”¶Ћў¬ £ї’э»Јір∞Є£Ї2 7 4 2£ї‘ціуєћ∆шљ”і•√жїэ£ђћбЄя‘≠Ѕѕјы”√¬ (Љ”њмЈі”¶Ћў¬ “ањ…)°£
£®2£©MoO3”лNH3°§H2OЈі”¶…ъ≥…(NH4)2MoO4£ђїѓ—ІЈі”¶Јљ≥ћ љќ™MoO3+2NH3°§H2O=(NH4)2MoO4+H2O£їЋб–‘—хїѓќп «÷Є”лЉоЈі”¶…ъ≥…—ќЇЌЋЃ£ђЈҐ…ъЈ«—хїѓїє‘≠Јі”¶£ђ’ыЄцЈі”¶єэ≥ћ£ђЄч‘™ЋЎїѓЇѕЉџЊщ√їЈҐ…ъ±дїѓ£ђЋщ“‘MoO3”–Ћб–‘—хїѓќпµƒ–‘÷ £ї’э»Јір∞Є£ЇMoO3+2NH3°§H2O=(NH4)2MoO4+H2O£ї”–°£
£®3£©ЅтЋбпІЋЃљвѕ‘Ћб–‘£ђЋЃљв∆љЇв≥£ эќ™Kh=Kw/Kb=c(NH3H2O)°Ѕc(H+)/c(NH4+),Ћщ“‘c(NH3H2O)/c(NH4+)=Kw/[Kb°Ѕc(H+)], c(H+)=10-amol/L£ђЋщ“‘c(NH3H2O)/c(NH4+)=10aKw/Kb£ђ![]() = Kb/10aKw=1.8°Ѕ10-5/10a°Ѕ10-14=1.8°Ѕ109-a£ї»фљЂ(NH4)2SO4ѕ°»№“Ї’фЈҐ≈®Ћх£ђ»№ЉЅЉх–°£ђ≈®ґ»‘ціу£ђNH4+ЋЃљвƒ№Ѕ¶Љх»х£ђЋщ“‘
= Kb/10aKw=1.8°Ѕ10-5/10a°Ѕ10-14=1.8°Ѕ109-a£ї»фљЂ(NH4)2SO4ѕ°»№“Ї’фЈҐ≈®Ћх£ђ»№ЉЅЉх–°£ђ≈®ґ»‘ціу£ђNH4+ЋЃљвƒ№Ѕ¶Љх»х£ђЋщ“‘![]() љЂ±діу£ї’э»Јір∞Є£Ї1.8°Ѕ109-a£ї±діу°£
љЂ±діу£ї’э»Јір∞Є£Ї1.8°Ѕ109-a£ї±діу°£
£®4£©ЄщЊЁћвЄшЌЉ±н–≈ѕҐњ…÷™£ђќ¬ґ»њЎ÷∆‘Џ15.5 °ж~100°ж÷ЃЉд£ђґ‘овЋбƒ∆»№“Їљш––’фЈҐ≈®Ћх£ђњ…“‘µ√µљNa2MoO4°§2H2O£ђ»їЇуљш––єэ¬Ћ°Ґѕіµ”°ҐЅјЄ…µ»≤ў„ч£ї“тќ™Љ”»»£ђїбіўљшNa2MoO4µƒЋЃљв£ђљш––ґаіќ÷ЎЄі≤ў„чЇу£ђƒЄ“Ї÷–µƒNaOH≈®ґ»‘љјі‘љіу£ђ“≤їбЋж„≈Na2MoO4°§2H2Oќц≥ц£ї’э»Јір∞Є£Ї’фЈҐ≈®Ћх£ђњЎ÷∆‘Џ15.5°ж“‘…ѕ(їт15.5 °ж~100°ж)љш––єэ¬Ћ(ѕіµ”°ҐЅјЄ…)£їƒЄ“Ї÷–µƒNaOH≈®ґ»‘љјі‘љіу£ђ„оЇуљбЊІћбіњ ±ЋжNa2MoO4°§2H2Oќц≥ц°£
£®5£©овЋбƒ∆»№“ЇЋЃљвѕ‘Љо–‘£ђ—«ѕхЋбƒ∆»№“ЇЋЃљвѕ‘Љо–‘£ђЉ”»лNaNO2њ…“‘“÷÷∆овЋбƒ∆µƒЋЃљв£ђґшЌ®»лµ™∆ш°ҐЉ”»л”Ќ÷ђ£ђ∆рµљЄфЊшњ’∆шµƒ„ч”√£ђ—ќЋбƒ№єїовЋбƒ∆Јі”¶£ђ∆р≤їµљ“÷÷∆овЋбƒ∆ЋЃљвµƒ„ч”√£ї’э»Ј—°ѕоA°£

°Њћвƒњ°њ“їґ®ћхЉюѕ¬£ђћЉЋЎЄ÷Єѓ і”л±н√жЋЃƒ§pHµƒєЎѕµ»зѕ¬£Ї
pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
Єѓ іњм¬э | љѕњм | ¬э | љѕњм | ||||
÷ч“™≤ъќп | Fe2£Ђ | Fe3O4 | Fe2O3 | FeO |
ѕ¬Ѕ–ЋµЈ®≤ї’э»Јµƒ «
A. ‘ЏpH<4µƒ»№“Ї÷–£ђ÷ч“™ЈҐ…ъќц«вЄѓ і
B. ‘ЏpH>6µƒ»№“Ї÷–£ђ÷ч“™ЈҐ…ъќь—хЄѓ і
C. ‘ЏpH>14µƒ»№“Ї÷–£ђ’эЉЂЈі”¶ќ™O2£Ђ4OH£≠£Ђ4e£≠===2H2O
D. ‘Џ÷уЈ–≥э—х∆шЇуµƒЉо–‘»№“Ї÷–£ђЄѓ іЋў¬ їбЉх¬э
°Њћвƒњ°њ—«ѕхх£¬»(NOCl) «”–їъЇѕ≥…÷–µƒ÷Ў“™ ‘ЉЅ°£їЎірѕ¬Ѕ–ќ ћв£Ї
£®1£©NOClЋд»ї≤їќ»ґ®£ђµЂ∆д‘≠„”Њщіпµљ8e-ќ»ґ®љбєє£ђNOClµƒµз„” љќ™_________________°£
£®2£©“їґ®ћхЉюѕ¬£ђ‘Џ√№±’»Ё∆ч÷–ЈҐ…ъЈі”¶£Ї2NOCl(g)![]() 2NO(g)+Cl2(g)£ђ∆д’эЈі”¶Ћў¬ ±ніп љќ™v’э=k°§cn( NOCl)(kќ™Ћў¬ ≥£ э)£ђ≤вµ√v’эЇЌc(NOCl)µƒєЎѕµ»з±н£Ї
2NO(g)+Cl2(g)£ђ∆д’эЈі”¶Ћў¬ ±ніп љќ™v’э=k°§cn( NOCl)(kќ™Ћў¬ ≥£ э)£ђ≤вµ√v’эЇЌc(NOCl)µƒєЎѕµ»з±н£Ї
–тЇ≈ | c(NOCl)/(mol°§L-1) | v’э/(mol°§L-1°§s-1) |
Ґў | 0.30 | 3.60°Ѕ10-9 |
ҐЏ | 0.60 | 1.44°Ѕ10-8 |
‘тn=_________£їk=___________°£
£®3£©25 °ж ±£ђ÷∆±Є—«ѕхх£¬»Ћщ…жЉ∞µƒ»»їѓ—ІЈљ≥ћ љЇЌ∆љЇв≥£ э»з±н£Ї
–тЇ≈ | »»їѓ—ІЈљ≥ћ љ | ∆љЇв≥£ э |
Ґў | 2NO2(g)+NaCl(s) | K1 |
ҐЏ | 4NO2(g)+2NaCl(s) | K2 |
Ґџ | 2NO(g)+Cl2(g) | K3 |
‘тЄ√ќ¬ґ»ѕ¬£ђ¶§H3=______kJ/mol£їK3=______£®”√K1ЇЌK2±н Њ£©°£
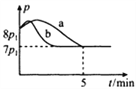
£®4£©25°ж ±£ђ‘Џћеїэќ™2LµƒЇг»Ё√№±’»Ё∆ч÷–Ќ®»л0.08 mol NOЇЌ0.04 molCl2ЈҐ…ъ…ѕ цЈі”¶Ґџ£ђ»фЈі”¶њ™ Љ”лљб ш ±ќ¬ґ»ѕаЌђ£ђ э„÷—є«њ“«ѕ‘ ЊЈі”¶єэ≥ћ÷–—є«њ(p)Ћж ±Љд(t)µƒ±дїѓ»зЌЉ«ъѕяaЋщ Њ£ђ‘т¶§H3=______£®ћо°∞>°±°∞<°±їт°∞=°±£©0£ї»ф∆дЋыћхЉюѕаЌђ£ђљцЄƒ±дƒ≥“їћхЉю£ђ≤вµ√∆д—є«њ(p)Ћж ±Љд(t)
µƒ±дїѓ»зЌЉ«ъѕяbЋщ Њ£ђ‘тЄƒ±дµƒћхЉю «_____________£їK3=___________L/mol£ї‘Џ5 min ±£ђ‘ў≥д»л0.08 mol NOЇЌ0.04 molCl2£ђ‘тїмЇѕ∆шћеµƒ∆љЊщѕаґ‘Ј÷„”÷ ЅњљЂ_____________£®ћо°∞‘ціу°±°Ґ°∞Љх–°°±їт°∞≤ї±д°±£©°£