题目内容
(10分)甲醇(CH3OH)的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上用3克氢气与二氧化碳反应生成气态甲醇和水蒸气,放出24.5千焦的热量。
①请写出该反应的热化学反应方程式: 利用该反应,在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
②从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为 。
③A中达到平衡时CO2的转化率为 ,B中a= 。
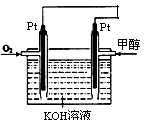
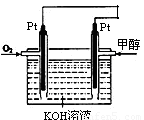
(2)某同学设计了一个甲醇燃料电池,其装置如图:
①写出图中通入甲醇这一极的电极反应式 。
②反应一段时间后,正极附近的碱性 (增强。减弱 不变)
(1)① (2分)
② 0.1c1 mol/(L·s) 或0.1c2 mol/(L·S)(任答对一个得分)(1分)
③ 60% (2分) 19.6(2分)
(2)① CH3OH- 6e-+ 8OH- = CO32-+6H2O (2分) ② 增强(1分)
解析:(1)①考查热化学方程式的书写②甲醇的浓度变化未c1,则根据方程式可知,CO2的浓度变化也是c1,所以反应速率为0.1c1 mol/(L·s)。放出的热量是29.4kJ,所以消耗的CO2是![]() ,所以转化率是60%。根据反应物投入量可知A和B是等效的,所以B中吸收的热量是49kJ-29.4kJ=19.6kJ。
,所以转化率是60%。根据反应物投入量可知A和B是等效的,所以B中吸收的热量是49kJ-29.4kJ=19.6kJ。
(3)甲醇失去电子,发生氧化反应,在负极通入。氧气在正极通入,得到电子发生还原反应,生成OH-,所以正极周围碱性增强。