��Ŀ����
����Ŀ����ҵ����ij����(����Cu2O��Al2O3��Fe2O3��SiO2) ��ȡͭ�IJ���������ͼ:��
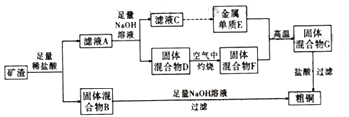
��֪:Cu2O+2H+=Cu+Cu2++H2O��
��1������Ԫ�����ڱ��е�λ��Ϊ___________����������B������������Һ��Ӧ�����ӷ���ʽΪ___________________��
��2����ҺA����Ԫ�صĴ��ڵ�������ʽΪ_______��.������_____________(�����ӷ���ʽ���������дCu2O ������ķ�Ӧ)��
��3������ҺC�е���Ԫ���Գ�����ʽ��������ѡ�ö����Լ�����д������ѷ�����Ӧ�����ӷ���ʽ:_______________��
��4����ҵ�����õ�ⷨ���д�ͭ����ʱ������������ȷ����______ (�����)��
a.�������У����������ļ�����һ����������������������
b.��ͭ�ӵ�Դ����������������Ӧ
c.�������У���ͭ���������ʾ�������
d.��⾫�������п�������������Һ���������Һ
��5��ȡ320g��������F ��Ӳ�ʲ������У�ͨ������������ּ��Ȼ�ԭ��������������80g���������õĻ�ԭ����������ϡ���ᷴӦ��������H2�ڱ�״�������Ϊ_______��
���𰸡� �������ڵ����� SiO2+2OH= ![]() +H2O Fe2�� 2Fe3��+Cu=2Fe2��+Cu2��
+H2O Fe2�� 2Fe3��+Cu=2Fe2��+Cu2�� ![]() +2H2O+CO2=Al(OH)3��+
+2H2O+CO2=Al(OH)3��+ ![]() b 44.8L
b 44.8L
�������������������������Ϣ��֪������������ϡ�����ܽ�õ���������B��B�к���ͭ�Ͷ������裬B����������������Һ��������������ܽ⣬���˵õ���ͭ����ҺA�к���ͭ���ӡ������ӡ��������ӵȣ�A����������������Һ������õ�����D����ҺC����ҺC�к���ƫ��������ӣ���һϵ��ת���õ�����E����֪EΪ����D�к�������������������ͭ�������յõ�������������ͭ�Ļ����F��E��F�ڸ����·������ȷ�Ӧ����������������ͭ�Ļ����C��C�������ܽ�Ҳ�õ���ͭ��
��1������Ԫ�����ڱ��е�λ��Ϊ�������ڵڢ��壻��������B������������Һ��Ӧ�����ӷ���ʽΪSiO2+2OH= ![]() +H2O��
+H2O��
��2����ҺA����Ԫ�صĴ��ڵ�������ʽΪFe2��������Fe2�������ӷ���ʽΪ2Fe3��+Cu=2Fe2��+Cu2����
��3������ҺC�е���Ԫ���Գ�����ʽ��������ѡ�ö����Լ����ö�����̼������Ԫ��Ϊ��ѷ������÷�Ӧ�����ӷ���ʽΪ![]() +2H2O+CO2=Al(OH)3��+
+2H2O+CO2=Al(OH)3��+ ![]() ��
��
��4����ҵ�����õ�ⷨ���д�ͭ����ʱ��a.�������У���������ͭ�ܽ��⣬��ͭ���õĽ���Ҳ�ܽ⣬������ֻ��ͭ�������������������ļ�������һ������������������������a����ȷ��b.��ͭ�������������ӵ�Դ����������������Ӧ��b��ȷ��c.�������У���ͭ��ֻ�б�ͭ���õĽ�����������c����ȷ��d.��⾫�������п����ÿ�����ͭ����Һ���������Һ����������ͭ��Һ���������Һ��d����ȷ��������ȷ����b��
��5��ȡ320g��������F��Ӳ�ʲ������У�ͨ������������ּ��Ȼ�ԭ��������������80g�����ٵ�����Ϊ��Ԫ�ص�������n(O)= ![]() ����n(H2)=n(H2O)=n(O)=5mol����Ӧ�е���ת��n(e-)= 2n(H2)=10mol���������غ�͵���ת���غ�ɵ���160n(Fe2O3)+80n(CuO)=320g��6n(Fe2O3)+2 n(CuO)=10mol����֮��n(Fe2O3)=1mol����ˣ����õĻ�ԭ�����к���2mol Fe�������õĻ�ԭ����������ϡ���ᷴӦ�����Բ���2mol H2��2mol H2�ڱ�״�������Ϊ44.8L��
����n(H2)=n(H2O)=n(O)=5mol����Ӧ�е���ת��n(e-)= 2n(H2)=10mol���������غ�͵���ת���غ�ɵ���160n(Fe2O3)+80n(CuO)=320g��6n(Fe2O3)+2 n(CuO)=10mol����֮��n(Fe2O3)=1mol����ˣ����õĻ�ԭ�����к���2mol Fe�������õĻ�ԭ����������ϡ���ᷴӦ�����Բ���2mol H2��2mol H2�ڱ�״�������Ϊ44.8L��

����Ŀ����ͼX��Y�ֱ���ֱ����Դ��������ͨ�����a�����������ӣ�d��������ɫ��������ų���������һ������ǣ� ��
ѡ�� | a ���� | d���� | X���� | ������Һ |
A | п | ͭ | ���� | CuSO4 |
B | ʯī | ʯī | ���� | NaOH |
C | �� | �� | ���� | AgNO3 |
D | ͭ | ʯī | ���� | CuCl2 |
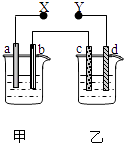
A.A
B.B
C.C
D.D