题目内容
【题目】硝酸与金属反应时,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。
[查阅资料]
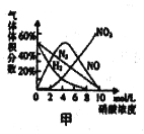
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示:
b.NO2沸点:21℃;NO沸点:-151℃
c.2NO2+2OH-=NO3-+NO2-+H2O,NO+NO2+2OH-=2NO2-+H2O
[实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
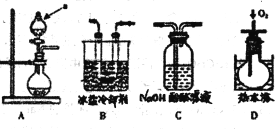
(1)后一个C装置的作用是_______,证明气体产物中有NO生成的实验现象是______。
(2)从第一个C装置中逸出的气体成分是________。
(3)溶液中还可能有一种还原产物,这种还原产物可能是_____,请设计实验验证你的猜想________;并写出生成该还原产物的化学方程式_____________
【答案】 吸收未被冷却的二氧化氮 C装置中酚酞溶液不褪色,D装置中有红棕色气体出现 氮气和氢气 硝酸铵 取少量A中溶液于试管中,加入浓氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口,如果试纸变蓝,则可证明有铵根离子存在,产物中含硝酸铵 4Mg+10HNO3=4Mg(NO3)2+3H2O+NH4NO3
【解析】(1)前一个C装置是吸收未被冷却的二氧化氮,防止其对后面一氧化氮的检验产生影响,一氧化氮为无色气体,遇到空气中的氧气能被氧化成红棕色的二氧化氮,所以看到C中酚酞溶液不褪色,D装置中有红棕色气体出现,则证明体产物中有NO生成;
(2)在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被氢氧化钠吸收,氢气和氮气不能被吸收,所以从后一个C装置中逸出的气体主要是氮气和氢气;
(3)硝酸被还成氮的氧化物都为气体,如果不是气体根据化合升降规则可知,应为铵盐,即A溶液中可能还有一种还原产物为NH4NO3,可以在所得溶液中加入氢氧化钠溶液并微热,用湿润的红色石蕊试纸检验,如果红色石蕊试纸变蓝,则可证明的铵根离子产生;Mg粉溶于稀硝酸生成NH4NO3,发生反应的化学方程式为4Mg+10HNO3=4Mg(NO3)2+3H2O+NH4NO3。
