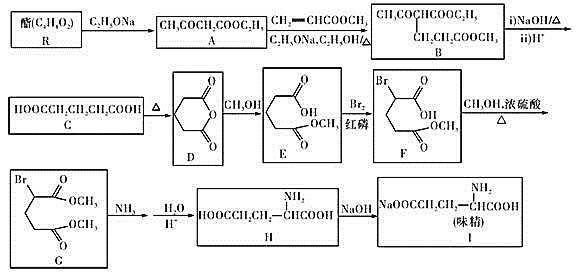
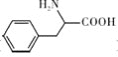
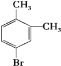
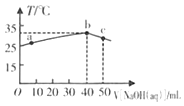
题目内容
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:

反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则![]() (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
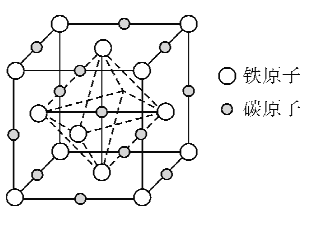
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
【答案】[Ar]3d5或1s22s23p63s23p63d5 O>N>C>H sp2杂化 平面三角形 分子 ABD 减少 NA(或6.02![]() 10-23)
10-23) ![]()
![]()
【解析】
(1)Fe为26号元素,基态Fe的电子排布式为1s22s22p63s23p63d64s2,失去3个电子生成Fe3+,则Fe3+的核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5;Fe(H2NCONH2)6](NO3)3中所含非金属元素为H、C、N、O,通常元素的非金属性越强,电负性越大,则所含非金属元素C、N、O、H中O的非金属性最强,H最弱,四者的电负性由大到小的顺序是O、N、C、H;Fe(H2NCONH2)6](NO3)3中尿素分子的结构简式为![]() ,C原子形成3个σ键,无孤对电子,所以是sp2杂化;NO3-中N的价层电子对数是3,且不存在孤对电子,所以NO3-的空间构型为平面三角形。答案:[Ar]3d5或1s22s22p63s23p63d65;O>N>C>H、sp2、平面三角形。
,C原子形成3个σ键,无孤对电子,所以是sp2杂化;NO3-中N的价层电子对数是3,且不存在孤对电子,所以NO3-的空间构型为平面三角形。答案:[Ar]3d5或1s22s22p63s23p63d65;O>N>C>H、sp2、平面三角形。
(2)卤素单质属于分子晶体,铝原子簇A113的性质与卤素相似,则原子簇A113也属于分子晶体。Na[Al(OH)4]属于离化合物,存在着离子键,铝是缺电子结构,能接受氢氧根离子给与的孤对电子形成配位键,氧氢之间可以形成极性键。所以Na[Al(OH)4]属于离化合物中含有离子键、极性键、配位键。答案:分子,ABD。
(3)每生成1mol氯吡苯脲,需要1mol2-氯-4-氨基吡啶、1mol异氰酸苯酯,反应过程中每个2-氯-4-氨基吡啶分子断裂一个σ键、每个异氰酸苯酯分子断裂一个π键,所以当σ键增加了1 mol时,π键减少了NA(或6.02![]() 10-23)个。答案:减少;NA(或6.02
10-23)个。答案:减少;NA(或6.02![]() 10-23)。
10-23)。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。因为![]() (咪唑)中的有5个原子参与形成π键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为
(咪唑)中的有5个原子参与形成π键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为![]() ;答案:
;答案:![]() 。
。
(5)晶胞结构分析可知一个晶胞中含铁原子8×1/8+6×1/2=4,碳原子12×1/4+1=4,化学式中铁原子和碳原子比为1:1,化学式为FeC;晶胞中最近的两个碳原子的距离设为x,立方体棱边的一半为a,则2a2=x2,a=![]() ,密度d=m/V=
,密度d=m/V=![]() ,解得x=
,解得x=![]() cm=
cm=![]() pm。答案:
pm。答案:![]() 。
。