题目内容
10.完成NaClO3氧化FeCl2的离子方程式:1ClO3-+6Fe2++6H+═1Cl-+6Fe3++3H2O.
分析 配平氧化还原方程式的一般步骤为:需先找出变价元素,利用化合价升降守恒或电子得失守恒法,先给变价元素前配上系数,最后借助元素守恒,电荷守恒依次配平其余元素.
解答 解:反应前为$Cl{O}_{3}^{-}$和Fe2+,反应后为Cl-和Fe3+,缺少O元素,考虑到溶液中,最终反应应该生成水,则且$Cl{O}_{3}^{-}$在酸性条件下氧化性较强,溶液为酸性条件下反应;氧化还原反应遵循电子得失守恒,这里$Cl{O}_{3}^{-}$→Cl-,降低6价,Fe2+→Fe3+,升高1价,为使化合价升降守恒,则需要在Fe2+前配上6,在$Cl{O}_{3}^{-}$配上1,反应方程式为:ClO3-+6Fe2++6H+═Cl-+6Fe3++3H2O.故答案为:1;6;6H+;1;6;3H2O.
点评 本题考查依据元素守恒推断参加反应的物质,同时考查配平氧化还原方程式,结合元素守恒,化合价升降守恒,电荷守恒解答.题目难度不大,是基础题.

练习册系列答案
相关题目
12.下列用水就能鉴别的一组物质是( )
| A. | 苯、己烷、四氯化碳 | B. | 甲苯、酒精、四氯化碳 | ||
| C. | 硝基苯、酒精、四氯化碳 | D. | 溴苯、酒精、醋酸 |
18.下列叙述正确的是( )
| A. | 加热能够抑制水的电离 | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关 | |
| C. | 原电池中发生的反应达到平衡时,该电池仍有电流产生 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
5.金刚石和石墨是碳元素的两种结构不同的单质,在101kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量.下列说法不正确的是( )
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石转化为石墨是物理变化 | |
| C. | 1 mol金刚石比1 mol石墨的总能量高 | |
| D. | 1 mol石墨和1 mol金刚石完全燃烧时释放的能量,石墨比金刚石少 |
2.下列各组液体混合物能用分液漏斗分离的是( )
| A. | 乙酸和水 | B. | 乙醇和水 | C. | 乙醇和乙酸 | D. | 苯和水 |
19.图中,R、W、X、Y、Z为元素周期表中前四周期的部分元素,下列有关叙述正确的是( )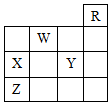

| A. | 五种元素中,只有Z为金属元素 | |
| B. | W位于ⅥA族,有+6、-2两种常见化合价 | |
| C. | X和Y的最高价氧化物对应水化物都是强酸 | |
| D. | X、Y、Z的气态氢化物的稳定性:Y>X>Z |
20.密闭容器中充入1mol N2和3mol H2,一定条件下反应达平衡.下列说法正确的是( )
| A. | 生成2 mol NH3 | |
| B. | 正反应和逆反应的速率都为零 | |
| C. | N2、H2和NH3的物质的量浓度相等 | |
| D. | N2、H2和NH3的物质的量浓度不再变化 |

 .
.