题目内容
某含铬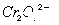 废水硫酸亚铁铵
废水硫酸亚铁铵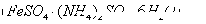 处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol
处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol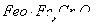 。不考虑处理过程中的实际损耗,下列叙述错误的是
。不考虑处理过程中的实际损耗,下列叙述错误的是
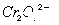 废水硫酸亚铁铵
废水硫酸亚铁铵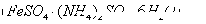 处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol
处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol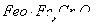 。不考虑处理过程中的实际损耗,下列叙述错误的是
。不考虑处理过程中的实际损耗,下列叙述错误的是
A
答案:A
Cr2O72―具有强氧化性,FeSO4·(NH4)2SO4·6H2O具有强还原性,二者发生氧化还原反应,Fe2+被氧化成Fe3+,Cr2O72―中+6价Cr被还原成+3价Cr。该反应中,Fe失电子的物质的量等于Cr得电子的物质的量,则有ny mol=3nx mol,即3x=y。据Cr、Fe 原子守恒可知,生成n mol FeO·FeyCrxO3时,消耗
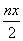 mol Cr2O72―,消耗n(y+1) mol硫酸亚铁铵,反应中转移电子的物质的量为
mol Cr2O72―,消耗n(y+1) mol硫酸亚铁铵,反应中转移电子的物质的量为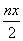 mol×6=3nx mol,又知3x=y则消耗硫酸亚铁铵的物质的量为n(3x+1) mol。故A错误,B、C、D正确。
mol×6=3nx mol,又知3x=y则消耗硫酸亚铁铵的物质的量为n(3x+1) mol。故A错误,B、C、D正确。
练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目

 试剂 ,离子方程式
试剂 ,离子方程式 
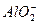 +2H2O
+2H2O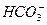 ====CaCO3↓+
====CaCO3↓+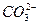 +2H2O
+2H2O