题目内容
【题目】(1)基态Cu2+的核外电子排布式为 ,在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。根据元素原子的外围电子排布特征,可将周期表分成五个区域,元素Cu属于 区。
(2)下列叙述不正确的是 。(填字母)
a.HCHO和CO2分子中的中心原子均采用sp杂化
b.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水
c.C6H6分子中含有6个σ键和1个大π键,C2H2是非极性分子
d.CO2晶体的熔点、沸点都比二氧化硅晶体的低,原因是CO2为分子晶体而二氧化硅是原子晶体
(3)氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。其中的C的杂化类型为 ,写出一种与 CN— 互为等电子体的单质分子式 。
(4)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
② 六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
a.共价键
b.非极性键
c.配位键
d.σ键
e.π键
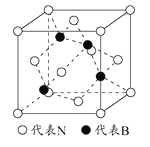
(5)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其晶胞结构与金刚石类似,一个该晶胞中含有 个氮原子, 个硼原子,设氮原子半径为a pm,硼的原子半径b pm ,求该晶胞的空间利用率 。(用含a、b的代数式表示)
【答案】(1)1s22s22p63s23p63d9或[Ar]3d9 (2分) 结构上Cu2+为3d9 ,而Cu+为3d10全充满更稳定 (2分) ds(1分)ac(2分)(3)N≡C-O-H(2分),sp杂化(1分),N2(1分)
(4)① 具有孤对电子(2分) ② b(1分),
(5)4(1分),4(1分), 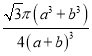 (2分)
(2分)
【解析】
试题分析:(1)铜的原子序数是29,则根据核外电子排布规律可知基态Cu2+的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9;由于结构上Cu2+为3d9 ,而Cu+为3d10全充满更稳定,因此在高温下CuO 能分解生成Cu2O;铜元素的核外电子排布式为1s22s22p63s23p63d104s1,因此元素Cu属于ds区。
(2)a.HCHO分子是平面形结构,碳原子是sp2杂化,CO2分子是直线形结构,则分子中的中心原子采用sp杂化,a错误;b.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水,b正确;c.C6H6分子中含有12个σ键和1个大π键,C2H2是直线形结构,是非极性分子,c错误;d.CO2晶体的熔点、沸点都比二氧化硅晶体的低,原因是CO2为分子晶体而二氧化硅是原子晶体,d正确;答案选ac。
(3)氰酸(HOCN)是一种链状分子,其分子内各原子最外层均已达到稳定结构,则氰酸的结构式为N≡C-O-H,其中的C的杂化类型为sp杂化;原子数和价电子数分别都相等的是等电子体,则与 CN— 互为等电子体的单质分子式为N2。
(4)①形成配合物的条件是一方提供空轨道,另一方提供孤对电子,所以与Fe原子或离子形成配合物的分子或离子应具备的结构特征是分子或离子中应有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4 —中亚Fe2+与CN-形成配位键,C与N之间形成1个![]() 键、2个
键、2个![]() 键,所以六氰合亚铁离子[Fe(CN)6]4 —中不含非极性共价键,答案选b。
键,所以六氰合亚铁离子[Fe(CN)6]4 —中不含非极性共价键,答案选b。
(5)根据晶胞结构可知该晶胞中含有![]() 个氮原子,4个硼原子;设氮原子半径为a pm,硼的原子半径b pm,晶胞的体对角线是4(a+b)pm,因此晶胞的边长是
个氮原子,4个硼原子;设氮原子半径为a pm,硼的原子半径b pm,晶胞的体对角线是4(a+b)pm,因此晶胞的边长是![]() ,所以该晶胞的空间利用率为
,所以该晶胞的空间利用率为 。
。

【题目】(1)对于反应2S02(g)+O2(g)=2SO3(g),当其他条件不变时,只改变一个反应条件。将生成SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 降低温度 | |
② | 压缩体积 | |
③ | 使用催化剂 |
(2)用铜片、锌片和稀硫酸及若干其他器材组合成一个原电池.如图所示。回答下列问题:

① 该原电池装置将_______(选填“化学能转化为电能”或“电能转化为化学能”);
② 此电池的负极是______,正极的电极反应方程式是________。
③ 该电池工作一段时间,将两个电极小心取出洗涤并晾干,经称量发现锌片比原来减少6.5g(锌的相对原子质量为:65)。请计算理论上导线中共通过了____mol电子。


