题目内容
(11分)2SO2(g)+O2(g)
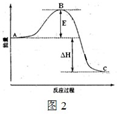
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 molSO3(g)的ΔH=-99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 molSO3(g)的ΔH=-99 kJ/mol。

请回答下列问题:
(1) 图中A、C分别表示_____ ___、____ ____,E的大小对该反应的反应热有无影响?________.该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是_____________________________。
(2) 图中ΔH=_____ ___kJ/mol.
(3) V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式:_____________________ __
_______________________________________________。
(4)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=__________mol/(L·min)、v(SO3)=________ mol/(L·min).
(5) 已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH= 。
(1)反应物具有的总能量;生成物具有的总能量;无影响;降低;使用适当的催化剂,活化能降低。(2)—198 (3)V2O5 + SO2 = 2VO2 + SO3 ;4VO2 + O2 = 2V2O5
(4)0.025;0.05 (5)—1185KJ/mol
【解析】(1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能。
(2)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1。
(3)依题意即可写出:SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5。
(4)根据反应速率之比等于相应的化学计量数之比可进行有关计算。
(5)已知反应①S(s)+O2(g)=SO2(g) △H1=-296 KJ·mol-1 , 反应②SO2(g)+1/2O2(g) =SO3(g) △H2=-99 KJ·mol-1 ,所以根据盖斯定律可知,①+②即得到S(s)+3/2O2(g)=SO3(g) ,因此 △H=△H1+△H2=-395 KJ·mol-1,所以由S(s)生成3 mol SO3(g)的ΔH=-395 KJ·mol-1×3=-1185 KJ·mol-1。

 科学实验活动册系列答案
科学实验活动册系列答案(1)请写出炉气制造即沸腾炉中黄铁矿燃烧的化学方程式 .
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
A、精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图1所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 、 .
B、接触室中2SO2(g)+O2(g)
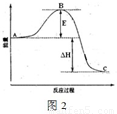
 2SO3(g),反应过程的能量变化如图2所示.
2SO3(g),反应过程的能量变化如图2所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
①图中C点表示 ,E的大小对该反应的反应热 (填“有”或“无”) 影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低”).
②反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”);图中△H= kJ?mol-1.
(3)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物.取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收.实验数据如下:
| 实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
| 第一次 | 1.570 | 0.340 |
| 第二次 | 3.140 | 0.680 |
| 第三次 | 4.710 | 0.510 |
| 第四次 | 6.280 |
②x的值为 .

 (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 molSO3(g)的ΔH=-99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 molSO3(g)的ΔH=-99 kJ/mol。