题目内容
在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )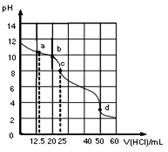
| A.a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B.b点:5c(Cl-)=4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3) |
| D.d点:c(Na+)<c(Cl-) |
C
解析试题分析: a点时碳酸钠与碳酸氢钠物质的量相等,但因两者水解程度不同,故碳酸根离子与碳酸氢根离子浓度不等;b点时碳酸钠还没有完全转化为碳酸氢钠,根据物料守恒可得:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3);c点为氯化钠与碳酸氢钠的混合液,根据质子守恒可得:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3),正确;d点时溶质只有氯化钠,所以c(Na+)=c(Cl-)。
考点:考查定量分析实验、溶液中的离子浓度大小比较、三大守恒的应用。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:( )
| A.H+、Mg2+、Al3+ | B.Mg2+、Al3+、Fe2+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
下列离子方程式书写正确的是
| A.钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu |
| B.铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
| C.石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
| D.FeI2溶液中通人少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
下列各组离子,一定能在指定环境中大量共存的是( )
| A.在含有大量I-的溶液中:Cl-、Fe3+、Al3+、Cu2+ |
| B.在由水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| C.在使pH试纸变红的溶液中:Fe2+、Na+、SO42—、ClO- |
| D.在加入Al能放出大量H2的溶液中:NH4+、SO42—、Cl-、HCO3— |
烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )
| A.曲线a表示Ba2+的物质的量的变化 |
| B.曲线c表示OH-的物质的量的变化 |
C.加入Ba(OH)2溶液50 mL反应的离子方程式为Ba2++OH-+H++SO42— BaSO4↓+H2O BaSO4↓+H2O |
D.加入Ba(OH)2溶液大于50 mL后,反应的离子方程式为OH-+H+ H2O H2O |
下列离子方程式正确的是( )
| A.利用醋酸溶解含碳酸钙的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
B.用铜为电极电解饱和食盐水:2Cl-+2H2O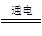 Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| C.在明矾溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2—+4NH4++2H2O |
| D.在小苏打溶液中加少量Ba(OH)2溶液:2HCO3—+Ba2++2OH-=BaCO3↓+2H2O+CO32— |
某无色溶液含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向所得水溶液中加入Ba(NO3)2溶液和稀硝酸 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
下列结论正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑥
C.不能确定的离子是①
D.不能确定的离子是③⑤
下列解释相关问题或实验的离子方程式不正确的是( )
A.NaClO溶液呈碱性:ClO-+H2O HClO+OH- HClO+OH- |
B.向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3H2O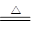 Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| C.粗盐提纯中除去Mg2+:Mg2++2OH-=Mg(OH)2↓ |
| D.工业上精炼粗铜的阴极反应:Cu-2e-=Cu2+ |
下列解释实验事实的反应方程式不正确的是( )
| A.盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O |
| B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
| C.用KSCN溶液检验Fe3+:Fe3++3SCN-=Fe(SCN)3 |
| D.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |