题目内容
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是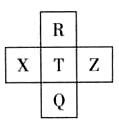
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
BD
解析试题分析:
审题“R单质在暗处与H2剧烈化合并发生爆炸”根据课本知识可知,R为F, Q为Br,T为Cl,X为S,Z为Ar;A.非金属性,主族元素同周期从左到右逐渐增强,Ar是零族,而Cl>S,错误;B.F的电子数为9,而Br为35,相差26,正确;C.同主族,从上到下,非金属性逐渐减弱,气态氢化物的稳定性也逐渐减弱,错误;D.非金属性Cl﹥Br,所以最高价氧化物对应的水化物的酸性也是Cl﹥Br,正确。
考点:卤族元素的性质,元素周期表与元素周期律。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列物质互为同分异构体的一组是( )
| A.35 Cl和37 Cl | B.正丁烷和异丁烷 | C.O2 和 O3 | D.H2O 和 H2O2 |
下列元素中基态原子的第一电离能最大的是( )
| A.B | B.C | C.N | D.O |
简单原子的原子结构可用下图形象地表示,其中?表示质子,○表示中子:①; ②
②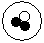 ;③
;③ 。则下列有关这三种原子的叙述中正确的是
。则下列有关这三种原子的叙述中正确的是
| A.属于不同的元素 | B.具有相同的质量数 | C.具有不同的核电荷数 | D.化学性质相似 |
以下表述不符合元素周期律的是
| A.酸性:H3PO4>HNO3>HClO4 |
| B.热稳定性:HF>H2O>NH3 |
| C.离子半径:F->Na+>Mg2+ |
| D.还原性:HI>HBr>HCl |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
| A.原子半径的大小顺序:rX>rY> rW >rQ |
| B.X、Y的最高价氧化物的水化物之间不能发生反应 |
| C.元素Q和Z能形成QZ2型的共价化合物 |
| D.Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
核反应堆通常使用235U和239Pu作为原料,研究和开发核能可以减少对化石燃料的依赖。下列有关说法正确的是
| A.239Pu比235U原子核内多4个中子 |
| B.核反应堆中使用的重水与水互为同位素 |
| C.石油、天然气等化石燃料属于可再生能源 |
| D.合理使用核能可有效减少温室气体的排放 |
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点。铊的相关信息如下图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子。下列有关卡片信息解读不正确的是 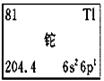
| A.铊的元素符号为Tl | B.铊原子的中子数为204 |
| C.铊位于第六周期ⅢA族 | D.铊的金属性比铝的金属性强 |
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是
| A.上述四种元素的原子半径大小为W<X<Y<Z |
| B.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| C.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |