题目内容
在水溶液中呈橙红色的Cr2O72-与呈黄色的CrO42-有下列平衡关系:Cr2O72-+H2O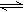 2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1)取少许上述溶液加入NaOH溶液,溶液变_________色,因为___ ________。
⑵向⑴中再加入过量稀H2SO4,则溶液呈__ __色,因为__________ _________。
⑶取少许原溶液,向其中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡_____ ____,溶液颜色将_____ ____。
【答案】
(1)黄 加入NaOH中和了H+,使c(H+)降低,平衡向正反应方向移动,c(Cr2O72-)减小,c(CrO42-)增大
(2)橙红 加入H2SO4,溶液中c(H+)增大,平衡向逆反应方向移动,c(CrO42-)降低,c(Cr2O72-)增大
(3)向正反应方向移动 变浅直到无色
【解析】考查外界条件对化学平衡的影响。
(1)加入氢氧化钠,中和溶液中的氢离子,氢离子浓度降低平衡向正反应方向移动,c(Cr2O72-)减小,c(CrO42-)增大,溶液显黄色。
(2)再加入硫酸,溶液中c(H+)增大,平衡向逆反应方向移动,c(CrO42-)降低,c(Cr2O72-)增大,所以显橙红色。
(3)加入Ba(NO3)2溶液,则生成BaCrO4黄色沉淀,c(CrO42-)降低,平衡向正反应方向移动,溶液的颜色将逐渐变浅,直到无色。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
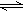 2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。