题目内容
| X | Y | Z | |
| R | |||
| W | |||
| J |
(1)在化合物YZ2中Y的化合价为
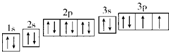
(2)R原子的电子轨道排布图为

(3)在X、Y、Z三种元素中,电负性由大到小的顺序是
(4)有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为
Y和Z能形成化合物YZ2,该化合物中,Y显+2价,Z为-1价,Z位于第二周期,所以Z是F元素、X是N元素、Y是O元素、R是S元素、W是Br元素、J是Kr元素,
(1)在化合物中,各元素化合价的代数和为0;电子层结构相同的离子,离子半径随着原子序数增大而减小;
(2)R是S元素,其原子核外有16个电子,在1s 2s 2p 3s 3p能级上电子数分别是2、2、6、2、4,据此书写其轨道表示式;
(3)同一周期元素中,元素的电负性随着原子序数的增大而增大,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,轨道中电子处于半满、全满、全空时最稳定;
(4)有一种酸HX3的酸性与醋酸相近,为弱酸,在水溶液里能电离出氢离子,所以该酸能和碱反应生成盐和水.
Y和Z能形成化合物YZ2,该化合物中,Y显+2价,Z为-1价,Z位于第二周期,所以Z是F元素、X是N元素、Y是O元素、R是S元素、W是Br元素、J是Kr元素,
(1)在化合物YZ2中Z显-1价,根据化合物中各元素化合价的代数和为0知,Y的化合价为+2价,电子层结构相同的离子,离子半径随着原子序数增大而减小,钠离子和氧离子半径大小顺序是O2->Na+或Na+<O2-,
故答案为:+2;O2->Na+或Na+<O2-;
(2)R是S元素,其原子核外有16个电子,在1s 2s 2p 3s 3p能级上电子数分别是2、2、6、2、4,所以其轨道表示式为:
 ,
,故答案为:
 ;
;(3)同一周期元素中,元素的电负性随着原子序数的增大而增大,所以在X、Y、Z三种元素中,电负性由大到小的顺序是F>O>N,元素的第一电离能随着原子序数的增大而呈增大趋势,轨道中电子处于半满、全满、全空时最稳定,N原子2p轨道处于半满状态,所以N元素的稳定性大于O元素,则N元素的第一电离能大于O元素,N元素的电离能大于O元素,
故答案为:F>O>N;>;N原子的2p轨道电子数为半充满状态,较稳定;
(4)有一种酸HX3的酸性与醋酸相近,为弱酸,在水溶液里能电离出氢离子,所以该酸能和碱反应生成盐和水,其离子反应方程式为:HN3+OH-═N3-+H2O,
故答案为:HN3+OH-═N3-+H2O.

 阅读快车系列答案
阅读快车系列答案(9分)下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
| X | Y | Z | |
| | R | | |
| | | W | |
| | | | J |
(1) 在化合物YZ2中Y的化合价为________;Y2-与Na+的半径大小为_______________;
(2) R原子的电子轨道排布图为___________________________________;
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是______________________;X与Y的第一电离能:X___Y(填“<”、“>”或“=”),其理由是__________________________________。
(4)有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为:___________________________________。
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
| X | Y | Z | |
| | R | | |
| | | W | |
| | | | J |
(1) 在化合物YZ2中Y的化合价为________;Y2-与Na+的半径大小为_______________;
(2) R原子的电子轨道排布图为
____________________________________________________________________________;
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是______________________;X与Y的第一电离能:X___Y(填“<”、“>”或“=”),其理由是__________________________________。
(4)有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为_________
__________________________________。
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
|
X |
Y |
Z |
|
|
|
R |
|
|
|
|
|
W |
|
|
|
|
|
J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1) 在化合物YZ2中Y的化合价为________;Y2-与Na+的半径大小为_______________;
(2) R原子的基态电子排布式为
__________________________________________________________________________;
(3)在X、Y、Z三种元素中,第一电离能由大到小的顺序是______________________;
(4)有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为___________________________________________。
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
|
X |
Y |
Z |
|
|
|
R |
|
|
|
|
|
W |
|
|
|
|
|
J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1) 在化合物YZ2中Y的化合价为________;Y2-与Na+的半径大小为_______________;
(2) R原子的电子轨道排布图为
____________________________________________________________________________;
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是______________________;X与Y的第一电离能:X___Y(填“<”、“>”或“=”),其理由是__________________________________。
(4)有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为_________
__________________________________。