题目内容
按要求填空
(1)a、e属于短周期的同族元素,a的原子半径最小,e的原子半径最大(稀有气体除外),写出它们组成化合物的化学式__________,其化学键的类型是 。
(2)C、N、O的第一电离能由大到小的顺序为
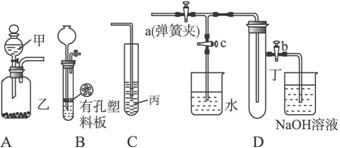
。NH3·H2O的电离方程式为 NH3·H2O NH4++OH-,试判断溶于水后,形成的合理结构是______。(填图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是______。(填图中的字母)

AsH3空间形状为______________;(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为__________;CaC2中C22―、N2与O22+互为等电子体,O22+的电子式可表示为 。
【答案】
(1)NaH 离子键 (2分) (2))N > O > C b (2分)
(3)三角锥型; sp2

【解析】
试题分析:(1)a、e属于短周期的同族元素,a的原子半径最小,为H,e的原子半径最大(稀有气体除外),
e为Na,故它们组成化合物的化学式NaH,其化学键的类型是离子键;(2)非金属性越大,电负性越
大,故N > O > C;NH3溶于水后,形成的NH3•H2O电离出铵根离子,结合图中H-O键断裂可知,
图中(b)符合;(3)AsH3空间形状为三角锥型,由于Ga原子周围只有3对成键电子对,故其杂化
方法为sp2;根据等电子体原理可知,O22+的电子式为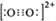 。
。
考点:电子式;原子核外电子排布;判断简单分子或离子的构型;“等电子原理”的应用;原子轨道杂化方式及杂化类型判断

练习册系列答案
相关题目