题目内容
25℃时,将1mol下列各物质加入适量水配成1 L溶液:①H2SO4,②H3PO4,③CH3COOH,④CaCO3,则各溶液的导电能力由强到弱的顺序应是
[ ]
A.③②①④
B.①④②③
C.①②③④
D.③②④①
答案:C
解析:
提示:
解析:
|
【巧解导析】H2SO4,CaCO3为强电解质,而H3PO4,CH3COOH为弱电解质;H2SO4,H3PO4,CH3COOH易溶于水,而CaCO3难溶于水;H3PO4与CH3COOH相比,CH3COOH是更弱的电解质.它们的电离方程式如下: H2SO4 H3PO4 CH3COOH CaCO3 电解质溶液的导电能力取决于溶液中自由移动的离子的浓度,CaCO3虽然是强电解质,但由于CaCO3难溶于水,故CaCO3溶液中Ca2+, |
提示:
|
【巧解点悟】解题关键点是弄清电解质溶液导电能力强弱的原因:自由移动离子浓度的大小.解题易错点:认为强电解质溶液的导电能力强,而弱电解质溶液的导电能力就一定弱而易错选B. |

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
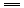 2H++
2H++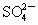
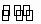 H++
H++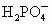 (以第一步电离为主)
(以第一步电离为主)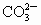
 的浓度极低,其导电能力也极弱.
的浓度极低,其导电能力也极弱.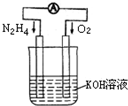 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.