题目内容
2013年12月2日1时30分我国成功将“嫦娥三号”探测器发射升空,将首次实现月球软着落和月面巡视勘察,长征系列火箭为卫星发射提供了技术保证.

(1)火箭推进器常以肼(N2H4)作为燃料,以O2、N2O4等作为氧化剂.
①NH3与NaClO反应可得到肼,该反应化学方程式为 .
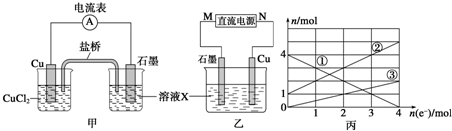
②以氧气作为氧化剂,肼燃烧过程中的能量变化如图甲所示,该反应热化学方程式为 .
(2)LiBH4有很高的燃烧热,可作火箭燃料,写出LiBH4与O2反应的化学方程式: .
(3)火箭残骸中常出现红棕色气体,原因为N2O4(g)?2NO2(g).
①当升温时,气体颜色变深,则该反应为 (填“吸热”或“放热”)反应.
②一定温度下,该反应的焓变为△H,现将1mol N2O4充入一恒压密闭容器中,图乙示意图正确且能说明反应达到平衡状态的是 (填字母).

(1)火箭推进器常以肼(N2H4)作为燃料,以O2、N2O4等作为氧化剂.
①NH3与NaClO反应可得到肼,该反应化学方程式为
②以氧气作为氧化剂,肼燃烧过程中的能量变化如图甲所示,该反应热化学方程式为
(2)LiBH4有很高的燃烧热,可作火箭燃料,写出LiBH4与O2反应的化学方程式:
(3)火箭残骸中常出现红棕色气体,原因为N2O4(g)?2NO2(g).
①当升温时,气体颜色变深,则该反应为
②一定温度下,该反应的焓变为△H,现将1mol N2O4充入一恒压密闭容器中,图乙示意图正确且能说明反应达到平衡状态的是
考点:热化学方程式,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)①NH3与NaClO反应可得到肼(N2H4),依据氧化还原反应化合价变化分析书写化学方程式;
②根据图示可知,反应物N2H4(1)、O2(g)的总能量大于生成物N2(g)、2H2O(g)的总能量,该反应为放热反应,据此写出反应的热化学方程式;
(2)燃料燃烧生成氧化物和水,依据原子守恒配平写出LiBH4与O2反应的化学方程式;
(3)①升高温度,平衡向吸热反应方向移动;
②根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断.
②根据图示可知,反应物N2H4(1)、O2(g)的总能量大于生成物N2(g)、2H2O(g)的总能量,该反应为放热反应,据此写出反应的热化学方程式;
(2)燃料燃烧生成氧化物和水,依据原子守恒配平写出LiBH4与O2反应的化学方程式;
(3)①升高温度,平衡向吸热反应方向移动;
②根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断.
解答:
解:(1)①NH3与NaClO反应可得到肼(N2H4),次氯酸钠做氧化剂,依据氧化还原反应的电子守恒和原子守恒写出该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
②根据图示曲线可知,反应物总能量大于生成物总能量,由N2H4(1)、O2(g)转化成生成物N2(g)、2H2O(g)会放出543.2kJ热量,该反应的热化学方程式为:N2H4(1)+O2(g)═N2(g)+2H2O(g)△H=-534.2 kJ?mol-1,
故答案为:N2H4(1)+O2(g)═N2(g)+2H2O(g)△H=-534.2 kJ?mol-1;
(2)LiBH4有很高的燃烧热,可做火箭的燃料,燃烧生成氧化物和水,反应的化学方程式为:2LiBH4+4O2
Li2O+B2O3+4H2O,
故答案为:2LiBH4+4O2
Li2O+B2O3+4H2O;
(3)①升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应;
故答案为:吸热;
②a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故答案为:ad.
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
②根据图示曲线可知,反应物总能量大于生成物总能量,由N2H4(1)、O2(g)转化成生成物N2(g)、2H2O(g)会放出543.2kJ热量,该反应的热化学方程式为:N2H4(1)+O2(g)═N2(g)+2H2O(g)△H=-534.2 kJ?mol-1,
故答案为:N2H4(1)+O2(g)═N2(g)+2H2O(g)△H=-534.2 kJ?mol-1;
(2)LiBH4有很高的燃烧热,可做火箭的燃料,燃烧生成氧化物和水,反应的化学方程式为:2LiBH4+4O2
| ||
故答案为:2LiBH4+4O2
| ||
(3)①升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应;
故答案为:吸热;
②a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故答案为:ad.
点评:本题考查了热化学方程式的书写、化学平衡状态的判断等知识,题目难度中等,注意掌握热化学方程式的书写原则,明确化学平衡状态的特征及判断方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
某化学课外活动小组,进行关于溶液中离子检验的探索性实验.下列是A、B、C、D四位同学分别对四个不同试样的检验结果.其中合理的是( )
| A、K+、H+、SO42-、OH- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、Cu2+、Na+、Cl-、SO42- |
观察下列几个装置示意图,有关叙述正确的是( )
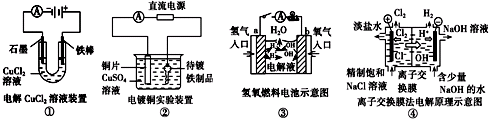

| A、装置①中阳极上析出红色固体 |
| B、装置②的待镀铁制品应与电源负极相连 |
| C、装置③中外电路电子由b极流向a极 |
| D、装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
230Th和232Th是90号元素钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
| A、230Th的中子数比核外电子数多140 |
| B、230Th和232Th的化学性质相同 |
| C、232Th转换成233U是化学变化 |
| D、Th元素的相对原子质量是231 |
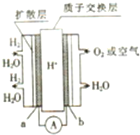 某质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极,下列手法中不正确的是( )
某质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极,下列手法中不正确的是( )| A、a极为该电池的负极 |
| B、该电池的正极反应式为O2+4e-+2H2O=4OH- |
| C、多孔活性铂电极有利于吸附气体,增大接触面积 |
| D、H+(质子)由负极移向正极 |

 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题