题目内容
下列说法正确的是
- A.由H原子形成1molH—H键要吸收热量
- B.化学变化中的能量变化的大小与反应物的质量多少无关
- C.酸与碱的稀溶液发生中和反应生成1molH2O时所释放的热量称为中和热
- D.锌锰干电池中碳棒是负极,锌片是正极
试题分析:氢原子形成氢分子,需要放出能量,A不正确;化学变化中的能量变化的大小与反应物的质量多少有关系,B不正确;锌锰干电池中碳棒是正极,锌片是负极,D不正确,答案选C。
考点:考查化学反应中的能量变化、中和热的判断以及干电池正负极的判断
点评:该题考查的知识点比较分散,但难度不大,试题难易适中,贴近高考,注重基础知识的巩固和训练,有利于培养学生的应试能力,提高学生分析问题、解决问题的能力。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:

它所对应的化学反应为:
(2)已知在一定温度下,
C(s)+CO2(g) 2CO(g)平衡常数K1;
CO(g)+H2O(g H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是: 。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是 。
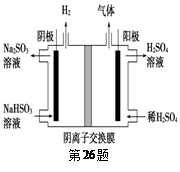
(6)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式 ,阳极区逸出气体的成分为 __________(填化学式)。