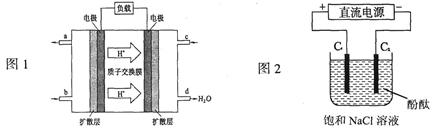
题目内容
下表是五种银盐的溶度积常数Ksp(25℃),下列说法不正确的是
A.25℃时五种银盐的饱和溶液中,c(Ag+)最大的是Ag2SO4溶液
B.在氯化银的悬浊液中加入Na2S溶液可以生成黑色的Ag2S
C.25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同
D.AgBr沉淀可以转化成AgI沉淀,而 AgI沉淀在一定条件下也可以转化成AgBr沉淀
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.4×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
B.在氯化银的悬浊液中加入Na2S溶液可以生成黑色的Ag2S
C.25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同
D.AgBr沉淀可以转化成AgI沉淀,而 AgI沉淀在一定条件下也可以转化成AgBr沉淀
C
试题分析:根据溶度积常数的表达式可计算出饱和溶液中离子的浓度,A正确;根据沉淀转化的方向,即向生成更难溶的方向转化可知,B正确;溶度积常数只与温度有关系,而与离子的浓度大小是无关系的。选项C中两种溶液中氯离子的浓度是不同的,虽然溶度积常数相同,但两溶液中c(Ag+)是不相同的,选项C不正确;只有溶液中离子积大于溶度积常数,就可以生成相应的沉淀,所以选项D正确,答案选D。
点评:本题容易错选D。这是受沉淀转化的实质影响的,即在一般条件下,沉淀是向更难溶的方向转化的。但这也仅是一般情况下,因为只要溶液中离子积大于溶度积常数,就可以转化相应的沉淀,而与溶度积常数大小并无直接的关系。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目