题目内容
在FeCl3和CuCl2的混合溶液中加入过量的铁粉,若充分反应后溶液的质量没有变化,则原混合溶液中Fe3+和Cu2+的物质的量浓度之比为( )
A.2∶7 B.1∶7
C.7∶1 D.5∶14
解析:选A 单质铁可以参与两个反应:①将FeCl3还原为FeCl2,此过程固体的质量是减少的;②与CuCl2发生置换反应,此过程固体的质量是增加的。①中质量的减少量等于②中质量的增加量。设溶液的体积为1 L,溶液中FeCl3的浓度为x mol/L,CuCl2的浓度为y mol/L,质量增减为z g,则
Fe+2FeCl3===3FeCl2
56 g 2 mol
z g x mol
Fe+CuCl2===Cu+FeCl2 Δm
1 mol (64-56) g
y mol z g
56x/2=(64-56)y,28x=8y,x∶y=2∶7。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案下列有关实验的现象或反应,与原理解释符合因果关系的是( )
| 现象或反应 | 原理解释 | |
| A | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝的金属性不活泼,不能与氧气反应[来源:学|科|网] |
| B | 硫与氧气只有在加热条件下才能进行反应 | 该反应为吸热反应 |
| C | 向碳酸钠和氢氧化钠溶液中滴加酚酞,溶液都呈红色 | 碳酸钠和氢氧化钠都是碱 |
| D | 常温下,铝制容器可用于盛装冷的浓硫酸 | 常温下,铝遇冷的浓硫酸发生钝化 |
下列实验的现象与对应结论均不正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸发生钝化 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
 B.可能有S
B.可能有S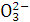
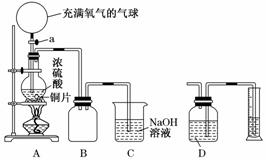
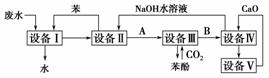
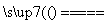 6Cu+SO2↑,下列说法中错误的是
6Cu+SO2↑,下列说法中错误的是