题目内容
15.将pH=2的盐酸和pH=12的氨水等体积混合后,在所得的混合溶液中,下列关系式正确的是( )| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(NH4+)<c(Cl-)<c(H+)<c(OH-) | D. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
分析 pH=2的盐酸的浓度为0.01mol/L,pH=12的氨水中氢氧根离子浓度为0.01mol/L,一水合氨为弱碱,溶液中只能部分电离出氢氧根离子,则氨水浓度远远大于0.01mol/L,两溶液等体积混合后溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒判断溶液中各离子浓度大小.
解答 解:氯化氢为强电解质,则pH=2的盐酸的浓度为0.01mol/L,
pH=12的氨水中氢氧根离子浓度为0.01mol/L,一水合氨为弱碱,溶液中只能部分电离,则氨水浓度远远大于0.01mol/L,
两溶液等体积混合后溶液显碱性,则c(OH-)>c(H+),
根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知:c(Cl-)<c(NH4+),
则混合液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故选D.
点评 本题考查了溶液中离子浓度大小比较、酸碱混合的定性判断,题目难度中等,注意掌握酸碱混合的定性判断方法,明确根据电荷守恒、盐的水解、物料守恒等知识判断溶液中离子浓度大小的方法,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
5.在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
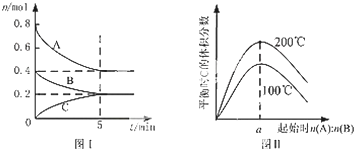

| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.02 mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入0.2molB和0.2molC,重新达到平衡前v(正)>v(逆) | |
| D. | 在200℃时,向容器中充入2mol A 和1mol B,达到平衡时,A 的体积分数大于0.5 |
6.下列反应中生成物总能量高与反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | C. | 酸碱中和 | D. | 氧化钙溶于水 |
3.在测定中和反应的反应热的实验中不需要用到的仪器是( )
| A. | 量筒 | B. | 温度计 | C. | 环形玻璃搅拌棒 | D. | 天平 |
10.一元强酸和一元强碱恰好完全中和时,它们一定相等的是( )
| A. | 体积 | B. | 质量 | ||
| C. | 物质的量浓度 | D. | H+和OH-的物质的量 |
20.已知溴酸银的溶解是吸热过程,在不同温度下溴酸银溶解平衡曲线如图所示,下列说法正确的是( )


| A. | T1>T2 | |
| B. | 加入AgNO3固体,可使a点变到c点 | |
| C. | a点和b点的Ksp相等 | |
| D. | c点时,在T1、T2两个温度下均有固体析出 |
7.NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L CCl4中含有的分子数大于0.1NA | |
| B. | 常温下,1 mol/L Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 分子数为NA的C2H4气体体积约为22.4 L,该条件一定是标准状况 | |
| D. | 标准状况下,4.2 g C3H6中含有的碳碳双键数一定为0.1 NA |
4.下列各组物质中既具有相同的最简式,又不属于同分异构体和同系物的是( )
①聚乙烯和乙烯 ②甲醛和葡萄糖 ③淀粉和纤维素④蔗糖和麦芽糖 ⑤聚乙烯和聚氯乙烯.
①聚乙烯和乙烯 ②甲醛和葡萄糖 ③淀粉和纤维素④蔗糖和麦芽糖 ⑤聚乙烯和聚氯乙烯.
| A. | ①②④⑤ | B. | ①②③ | C. | ①③④⑤ | D. | ①②③⑤ |
5.常温下,下列物质的状态是气体的是( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CHCl3 | D. | C6H14 |