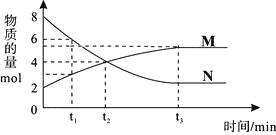
题目内容
【题目】高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:
(1)配平下列化学方程式,并标明电子转移的方向与数目:
________Fe(OH)3+________NaOH+________NaClO→________Na2FeO4+________NaCl+________H2O,___________
(2)该反应中还原产物是________(填写化学式),________元素被氧化,氧化剂的电子式为________。
(3)当反应中有1mol Na2FeO4生成,转移的电子有________mol.
(4)如果配制250mL 0.1mol/L NaOH溶液,需要称取________g NaOH固体,所需的仪器有玻璃棒、胶头滴管、烧杯、________、________。
【答案】2;4;3;2;3;5;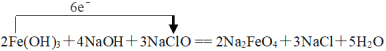
![]() Fe
Fe ![]() 3 1.0 托盘天平 250mL容量瓶
3 1.0 托盘天平 250mL容量瓶
【解析】
⑴反应中Fe(OH)3 → Na2FeO4,Fe元素化合价由+3价升高为+6价。升高3价,NaClO → NaCl,Cl元素的化合价由+1价降低为-1价,降低2价,化合价升降最小公倍数为6,故Fe(OH)3系数为2,NaClO系数为3,由Fe元素守恒故Na2FeO4系数为2,由Cl元素守恒NaCl系数为3,由Na元素守恒NaOH系数为4,由H元素守恒H2O系数为5,配平后方程式为:2Fe(OH)3+4NaOH+3NaClO == 2Na2FeO4+3NaCl+5H2O,电子转移为: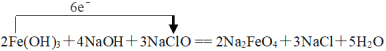 ,故答案为:2;4;3;2;3;5;
,故答案为:2;4;3;2;3;5;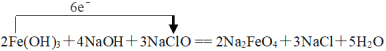 ;
;
⑵该反应中氧化剂是次氯酸钠,铁元素化合价升高,被氧化,次氯酸钠被还原对应还原产物为氯化钠,氯化钠为离子化合物,故答案分别为NaCl;Fe;![]() ;
;
⑶根据方程式元素化合价变化可以知道,反应有2 mol Na2FeO4生成,转移6 mol 电子,则生成1 mol Na2FeO4,转移3 mol电子;故答案为3;
⑷如果配制250mL 0.1mol/L NaOH溶液,需要称取氢氧化钠质量为:![]() ,
,
用到的仪器:托盘天平、钥匙、烧杯、玻璃棒、250 mL容量瓶、胶头滴管,所以需要定量仪器:托盘天平、250 mL容量瓶;故答案为1.0;托盘天平;250 mL容量瓶。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案