��Ŀ����
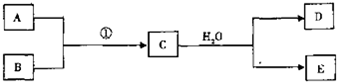
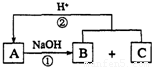
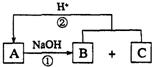 ����ͼ��ʾ��ת����ϵ�У�A��B��C����ѧ��ѧ�г��������ʣ�������ͬһ��Ԫ��R��������Ԫ����������������18���ش��������⣮��˵����ͼ�в���R�IJ��������ȥ����Ӧ�ڵIJ���֮һ��A��
����ͼ��ʾ��ת����ϵ�У�A��B��C����ѧ��ѧ�г��������ʣ�������ͬһ��Ԫ��R��������Ԫ����������������18���ش��������⣮��˵����ͼ�в���R�IJ��������ȥ����Ӧ�ڵIJ���֮һ��A��
��1����AΪһ����ɫ�����嵥�ʣ���AΪ______��д��A��ˮ��Ӧ�����ӷ���ʽ______��
��2����AΪ��ɫ��ζ����̬���������A��NaOH��Һ��Ӧ�����������ֻ����B��ֻ����C��ͬʱ����B��C������A�Ļ�ѧʽΪ______��д��A��NaOH��Һ��Ӧֻ����B�Լ�ֻ����C�����ӷ���ʽ______��______��
�⣺��1����A�ǻ���ɫ���壬��A��Cl2��������ˮ��Ӧ��������ʹ����ᣬ���ӷ�Ӧ����ʽΪ��Cl2+H2O?H++Cl-+HClO���ʴ�Ϊ��Cl2��Cl2+H2O?H++Cl-+HClO��
��2����A����ɫ��ζ����̬�����������A�Ƕ�����̼��������̼������������Һ��Ӧ����������̼����ʱ������̼���ƣ���������̼����ʱ����̼�����ƣ�����A������������Һ��Ӧֻ����B��Cʱ�����ӷ���ʽ�ֱ�Ϊ��CO2+2OH-=CO32-+H2O��CO2+OH-=HCO3-���ʴ�Ϊ��CO2��CO2+2OH-=CO32-+H2O��CO2+OH-=HCO3-��
��������1����A�ǻ���ɫ���壬��A��������������ˮ��Ӧ��������ʹ����
��2����A����ɫ��ζ����̬�����������A�Ƕ�����̼��������̼������������Һ��Ӧ����������̼����ʱ������̼���ƣ���������̼����ʱ����̼�����ƣ�
���������⿼�������ƶϣ���ȷ���ʵ������ǽⱾ��ؼ����������ʵ���ɫ��״̬����ζ��ȷ�����壬�ٸ������ʵ���������ɣ��ѶȲ���
��2����A����ɫ��ζ����̬�����������A�Ƕ�����̼��������̼������������Һ��Ӧ����������̼����ʱ������̼���ƣ���������̼����ʱ����̼�����ƣ�����A������������Һ��Ӧֻ����B��Cʱ�����ӷ���ʽ�ֱ�Ϊ��CO2+2OH-=CO32-+H2O��CO2+OH-=HCO3-���ʴ�Ϊ��CO2��CO2+2OH-=CO32-+H2O��CO2+OH-=HCO3-��
��������1����A�ǻ���ɫ���壬��A��������������ˮ��Ӧ��������ʹ����
��2����A����ɫ��ζ����̬�����������A�Ƕ�����̼��������̼������������Һ��Ӧ����������̼����ʱ������̼���ƣ���������̼����ʱ����̼�����ƣ�
���������⿼�������ƶϣ���ȷ���ʵ������ǽⱾ��ؼ����������ʵ���ɫ��״̬����ζ��ȷ�����壬�ٸ������ʵ���������ɣ��ѶȲ���

��ϰ��ϵ�д�
 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
�����Ŀ
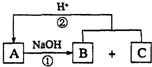 ����ͼ��ʾ��ת����ϵ�У�A��B��C����ѧ��ѧ�г��������ʣ�������ͬһ��Ԫ��R��������Ԫ����������������18���ش��������⣮��˵����ͼ�в���R�IJ��������ȥ����Ӧ�ڵIJ���֮һ��A��
����ͼ��ʾ��ת����ϵ�У�A��B��C����ѧ��ѧ�г��������ʣ�������ͬһ��Ԫ��R��������Ԫ����������������18���ش��������⣮��˵����ͼ�в���R�IJ��������ȥ����Ӧ�ڵIJ���֮һ��A��