题目内容
(2009?广州二模)构成物质的微粒种类及相互间的作用力是决定物质表现出何种物质性质的主要因素.
(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体类型为
(2)氢键作用常表示为“A…HB“,其中A\B为电负性很强的一类原子,如
(列举三种.X、Y两种物质和部分物质性质如下表,二者物质性质有差异的主要原因是
(3)钙是人体所需的重要元素之一,有一种补钙剂--抗坏血酸的组成为Ca(C6H7O6)?2H2O]其结构示意图如下:
该物质中存在的化学键类型包括
A.金属键B.离子键C.共价键D.配位键
(4)①CH2=CH2、②CH≡CH、③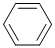 ④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是
④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是
(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体类型为
分子晶体
分子晶体
;| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X | 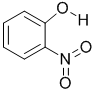 |
0.2 | 45 | 100 |
| Y | 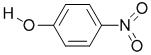 |
1.7 | 114 | 295 |
N、O、F
N、O、F
(列举三种.X、Y两种物质和部分物质性质如下表,二者物质性质有差异的主要原因是
X物质形成分子内氢键,Y物质形成分子间氢健
X物质形成分子内氢键,Y物质形成分子间氢健
(3)钙是人体所需的重要元素之一,有一种补钙剂--抗坏血酸的组成为Ca(C6H7O6)?2H2O]其结构示意图如下:

该物质中存在的化学键类型包括
BCD
BCD
(填字母)A.金属键B.离子键C.共价键D.配位键
(4)①CH2=CH2、②CH≡CH、③
 ④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是
④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是л键
л键
.这四种分子中碳原子采取sp2杂化的是①③④
①③④
(填序号).分析:(1)根据信息可知三氯化铁的晶体为分子晶体;
(2)电负性强的元素有F、O、N,吸引电子的能力强,分子之间易形成氢键;
(3)非金属元素之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键;
(4)不饱和键中的л键不稳定,易断裂;利用化合物中的成键来分析杂化.
(2)电负性强的元素有F、O、N,吸引电子的能力强,分子之间易形成氢键;
(3)非金属元素之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键;
(4)不饱和键中的л键不稳定,易断裂;利用化合物中的成键来分析杂化.
解答:解:(1)三氯化铁,其熔点:282℃,沸点315℃,在300℃以上升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.符合分子晶体的特征,故为三氯化铁分子晶体,
故答案为:分子晶体;
(2)电负性强的元素有F、O、N,吸引电子的能力强,由信息可知Y的熔沸点较高,是因X物质形成分子内氢键,Y物质形成分子间氢健,
故答案为:N、O、F;X物质形成分子内氢键,Y物质形成分子间氢健;
(3)非金属元素C、O,C、H之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键,故答案为:BCD;
(4)因不饱和键中的л键不稳定,易断裂,则能发生加成反应,又①③④中C原子上没有孤对电子,都有3个σ键,则杂化类型为sp2,②中为sp杂化,
故答案为:л键;①③④.
故答案为:分子晶体;
(2)电负性强的元素有F、O、N,吸引电子的能力强,由信息可知Y的熔沸点较高,是因X物质形成分子内氢键,Y物质形成分子间氢健,
故答案为:N、O、F;X物质形成分子内氢键,Y物质形成分子间氢健;
(3)非金属元素C、O,C、H之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键,故答案为:BCD;
(4)因不饱和键中的л键不稳定,易断裂,则能发生加成反应,又①③④中C原子上没有孤对电子,都有3个σ键,则杂化类型为sp2,②中为sp杂化,
故答案为:л键;①③④.
点评:本题考查物质结构与性质,熟悉物质的物理性质及物质的成键即可解答,难度较大,注重学生对信息的处理,较好的考查学生分析问题、解决问题的能力.

练习册系列答案
相关题目