题目内容
【题目】偏四氯乙烷是一种常见化工原料,以偏四氯乙烷和烯烃(C5H10)为原料合成某种六元环酯(C7H10O4)的合成路线如下: ![]()
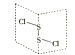
已知:一个碳原子上连接2个﹣OH不稳定,容易脱水变成 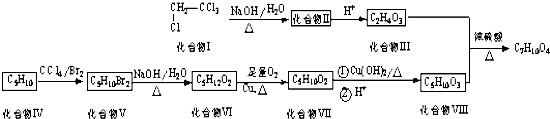
(1)化合物II中能与能与金属钠反应的官能团名称为 .
(2)化合物IV合成化合物V的反应类型为 , 化合物V合成化合物VI反应类型为 .
(3)写出由化合物VI合成化合物VII的反应方程式 .
(4)有机物R是化合物IV的同分异构体,R能使溴水褪色,且其核磁共振氢谱中有4组峰,有机物R的结构简式为 , 该六元环酯(C7H10O4)的结构简式为
(5)参照上合成路线,设计以有机物Cl2CH2﹣CH2Cl2和乙二醇为原料合成聚乙二酸乙二醇酯的合成路线.
【答案】
(1)羟基
(2)加成反应;取代反应
(3)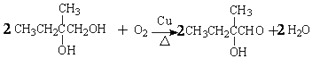
(4)![]() ;
;![]()
(5)
【解析】解:(1)化合物Ⅱ为HOCH2COONa,化合物II中能与能与金属钠反应的官能团名称为羟基,所以答案是:羟基;(2)根据上面的分析可知,化合物IV合成化合物V的反应类型为加成反应,化合物V合成化合物VI反应类型为取代反应,
所以答案是:加成反应;取代反应;(3)由化合物VI合成化合物VII的反应方程式为  ,
,
所以答案是: 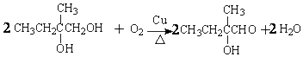 ;(4)有机物R是化合物IV的同分异构体,R能使溴水褪色,说明有碳碳双键,且其核磁共振氢谱中有4组峰,说明有4种位置的氢,所以有机物R的结构简式为
;(4)有机物R是化合物IV的同分异构体,R能使溴水褪色,说明有碳碳双键,且其核磁共振氢谱中有4组峰,说明有4种位置的氢,所以有机物R的结构简式为 ![]() ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为 ![]() ,
,
所以答案是: ![]() ;
; ![]() ;(5)以有机物Cl2CH2﹣CH2Cl2和乙二醇为原料合成聚乙二酸乙二醇酯,可以用Cl2CH2﹣CH2Cl2进行碱性水解得乙二醛,乙二醛氧化得乙二酸,乙二酸与乙二醇发生缩聚反应生成聚乙二酸乙二醇酯,反应的合成路线为
;(5)以有机物Cl2CH2﹣CH2Cl2和乙二醇为原料合成聚乙二酸乙二醇酯,可以用Cl2CH2﹣CH2Cl2进行碱性水解得乙二醛,乙二醛氧化得乙二酸,乙二酸与乙二醇发生缩聚反应生成聚乙二酸乙二醇酯,反应的合成路线为 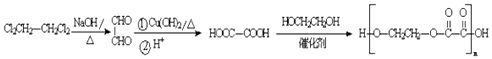 ,
,
所以答案是: 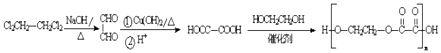 .
.

【题目】现有部分短周期元素的性质或原子结构如下表:
元素 | 元素性质或原子的结构 |
T | 2p轨道能级电子数比s能级电子数多1个 |
X | L层p能级电子数比s能级电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有3个未成对电子 |
(1)写出元素X的离子结构示意图: . 写出元素Z的简单气态氢化物的电子式:
(2)写出元素Y的最高价氧化物对应的水化物与KOH反应的化学方程式: .
(3)T、Y、Z三种元素的单质中化学性质明显不同于其他单质的是(填元素符号,下同);元素T与氯化素相比,非金属性较强的是 , 下列表述中能证明这一事实的是(填字母).
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出来
c.氯与T形成化合物中,氯元素呈正价.