题目内容
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g); ΔH1
CH3OH(g); ΔH1
反应II: CO2(g) + 3H2(g) CH3OH(g) +H2O(g);ΔH2
CH3OH(g) +H2O(g);ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极通入的物质为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
反应I: CO(g) + 2H2(g)
 CH3OH(g); ΔH1
CH3OH(g); ΔH1反应II: CO2(g) + 3H2(g)
 CH3OH(g) +H2O(g);ΔH2
CH3OH(g) +H2O(g);ΔH2①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极通入的物质为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
(1)①Ⅰ②﹤③0.8, 250℃(2)①O2②2CH3OH+3O2+4KOH=2K2CO3+6H2O
(1)①反应I只生成甲醇,符合绿色化学思想,原子利用率100%;
②由表中数据可知随温度的升高,K逐渐减小,说明平衡左移,即正反应是放热反应;
③ CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)
初c: 1 3 0
△c: 0.8 1.6 0.8
平c: 0.2 1.4 0.8
K=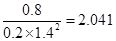 ,比照表中数据可知,温度为250℃
,比照表中数据可知,温度为250℃
(2)①燃烧电池的正极得电子,发生还原反应,所以通往的是氧气
②由表中数据可知随温度的升高,K逐渐减小,说明平衡左移,即正反应是放热反应;
③ CO(g) + 2H2(g)
 CH3OH(g)
CH3OH(g)初c: 1 3 0
△c: 0.8 1.6 0.8
平c: 0.2 1.4 0.8
K=
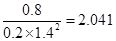 ,比照表中数据可知,温度为250℃
,比照表中数据可知,温度为250℃(2)①燃烧电池的正极得电子,发生还原反应,所以通往的是氧气

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 O2(g) ="=" H2O(l);△H= —142.9kJ/mol
O2(g) ="=" H2O(l);△H= —142.9kJ/mol 2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
 NO2(g)+CO(g)△H=+234 kJ/mol
NO2(g)+CO(g)△H=+234 kJ/mol TiCl4+2CO
TiCl4+2CO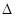 H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1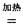 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因 (用适当化学方程式辅以必要的文字说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因 (用适当化学方程式辅以必要的文字说明)。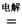 Mg+Cl2 TiCl4+2Mg
Mg+Cl2 TiCl4+2Mg 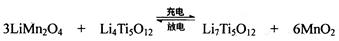 ,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向 。
,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向 。