题目内容
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
⑴.已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
⑵.将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g)![]() 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。
则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
⑶.当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.改变反应的催化剂 D.降低反应的温度
⑷.反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
 |
(1) 4FeS2(s)+11O2(g)![]() 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol (3分)
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol (3分)
(2)K = 1.6×103 (2分)
SO2的平衡转化率 =![]() ×100% = 80% (2分)
×100% = 80% (2分)
(3)B(1分,多选不得分)
(4)(3分) 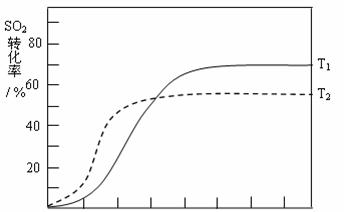

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
| |||||||||||||||||||
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
|
物质名称 |
溶度积(Ksp) |
pH值 |
|
|
开始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。